题目内容
2.水煤气(主要成分CO、H2)是重要的燃料和化工原料,可用水蒸气通过炽热的炭层制得.已知:C(s)+H2O(g)═CO(g)+H2(g)△H=+131.3kJ/mol-1①
C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5kJ/mol-1②
CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0kJ/mol-1③
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ/mol-1④
H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8kJ/mol-1⑤
(1)将2.4g炭转化为水煤气,再完全燃烧,整个过程的△H=-78.7kJ/mol-1.
(2)由CO、H2在一定条件下获得汽油的替代品甲醇,甲醇燃烧的热化学方程式CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-726.5kJ/mol-1,试写出由CO、H2生成甲醇的热化学方程式CO(g)+2H2(g)═CH3OH(l)△H=-128.1 kJ/mol.
分析 (1)将炭转化为水煤气,再完全燃烧,最终燃烧得到二氧化碳与水,根据盖斯定律,反应放出的热量为C燃烧生成二氧化碳放出的热量,由②+③可得:C(s)+O2(g)═CO2(g)△H=-393.5 kJ/mol,据此计算;
(2)已知:⑥CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H1=-726.5 kJ/mol,
③CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0kJ/mol
⑤H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8kJ/mol
根据盖斯定律,③+⑤×2-⑥可得:CO(g)+2H2(g)═CH3OH(l),焓变也进行需要计算.
解答 解:(1)将炭转化为水煤气,再完全燃烧,最终燃烧得到二氧化碳与水,根据盖斯定律,反应放出的热量为C燃烧生成二氧化碳放出的热量,由②+③可得:C(s)+O2(g)═CO2(g)△H=-393.5 kJ/mol,故将2.4g炭转化为水煤气,再完全燃烧,整个过程的△H=-393.5 kJ/mol×$\frac{2.4g}{12g}$=-78.7kJ/mol,
故答案为:-78.7;
(2)已知:⑥CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H1=-726.5 kJ/mol,
③CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0kJ/mol,
⑤H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8kJ/mol,
根据盖斯定律,③+⑤×2-⑥可得:CO(g)+2H2(g)═CH3OH(l),则△H=[-283.0+(-285.8)×2-(-726.5)]kJ/mol=-128.1 kJ/mol,
故答案为:CO(g)+2H2(g)═CH3OH(l)△H=-128.1 kJ/mol.
点评 本题考查反应热有关计算、热化学方程式书写,为高频考点,侧重于学生的分析能力和计算能力的考查,本题注意把握盖斯定律的理解与灵活应用,难度中等.

| A. | 丁达尔效应可用于鉴别胶体和溶液 | |
| B. | 胶体粒子的直径在1~100 nm之间 | |
| C. | 胶体一定是混合物 | |
| D. | 将FeCl3稀溶液溶于冷水即可制得Fe(OH)3胶体 |
| A. | 需要加热才能发生的反应一定是吸热反应,吸热反应的生成物总能量一定高于反应物总能量 | |
| B. | 同温同压下,H2(g)+Cl2(g)═2HCl(g) 在光照和点燃条件下的△H不同 | |
| C. | 一定条件下,0.5 mol N2和1.5 mol H2置于某密闭容器中充分反应生成NH3气,放热19.3kJ,其热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ/mol | |
| D. | 一定条件下4 HCl(g)+O2(g)═2Cl2(g)+2H2O(g),当1 mol O2反应放出115.6 kJ热量,键能如下所示,则断裂1 mol H-O键与断裂1 mol H-Cl键所需能量差为31.9 kJ Cl2(g)$\stackrel{243kJ/mol}{→}$2Cl(g) O2(g)$\stackrel{498kJ/mol}{→}$2O(g) |
反应②:I3-(aq)?I2(aq)+I-(aq)△H2;
反应①的化学平衡常数K1与温度的关系如表:
| t/℃ | 5 | 15 | 25 | 35 | 50 |
| K1 | 1100 | 841 | 680 | 533 | 409 |
(1)若反应②的化学平衡常数为K2,在相同温度下,K1•K2=1.
(2)上述反应①的△H1<0(填“>”、“=”、“<”);若升高温度,则I2的溶解速率会加快(填“加快”、“减慢”或“不变”).
(3)能判断反应①已达到平衡的依据是BC
A.容器中的压强不再改变 B.溶液的颜色不再改变
C.I-浓度不再变化 D.正逆反应速率均为0
(4)某温度下,反应①的化学平衡常数为800.在该温度下,向甲、乙、丙三个容器中分别加入I2和I-,这两种物质的起始浓度如下:
| 起始浓度(mol/L) | 甲 | 乙 | 丙 |
| c(I2) | 0.1 | 0.2 | 0.2 |
| c(I-) | 0.2 | 0.1 | 0.2 |
(1)常温下,控制KMnO4溶液初始浓度相同,调节不同的初始pH和草酸溶液用量,做对比实验,请完成以下实验设计表.
| 实验 编号 | 温度 | 初始pH | 0.1mol/L 草酸溶液/mL | 0.01mol/L KMnO4溶的 体积/mL | 蒸馏水 体积/mL | 待测数据(反应混合液褪色 时间/s) |
| ① | 常温 | 1 | 20 | 50 | 30 | t1 |
| ② | 常温 | 2 | 20 | 50 | 30 | t2 |
| ③ | 常温 | 2 | 40 | a | b | t3 |
(2)该反应的离子方程式5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O.
(3)若t1<t2,则根据实验①和②得到的结论是溶液的pH对该反应的速率有影响.
(4)请你设计实验④验证MnSO4对该反应起催化作用,完成表中内容.
| 实验方案(不要求写出具体操作过程) | 预期实验结果和结论 |
| 若反应混合液褪色时间小于实验①中的t1,则MnSO4对该反应起催化作用(若褪色时间相同,则MnSO4对该反应无催化作用) |
V mL.请回答下列问题:
①该测定方法中不需要(填“需要”或“不需要”)加入指示剂;
②计算得KMnO4溶液的c(KMnO4)=$\frac{20w}{63V}$ mol/L.(请写出最后化简结果)
 某温度时,在一个容积为2L的密闭容器中,X、Y、Z,三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个容积为2L的密闭容器中,X、Y、Z,三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
 CH3COOCH2CH3+H2O;反应类型酯化反应.
CH3COOCH2CH3+H2O;反应类型酯化反应.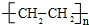 ;反应类型加聚反应.
;反应类型加聚反应.