题目内容
4.纳豆是一种减肥食品,从其中分离出一种由C、H、O三种元素组成的有机物A,为确定其结构进行如下各实验:①6.0g物质A在一定条件下完全分解,生成3.36L(标准状况)一氧化碳和1.8g H2O.
②中和24g物质A,消耗0.4mol的氢氧化钠溶液.③1mol物质A完全转化为酯,需乙醇2mol; 1mol物质A能与足量钠反应放出1.5mol的氢气.试确定:
(1)A的式量及化学式;
(2)A的结构简式.
分析 (1)1mol物质A完全转化为酯,需乙醇2mol,则A分子中含有2个-COOH;完全中和24g物质A,需要消耗NaOH为0.4mol,则24gA的物质的量为0.2mol,据此可计算出A的摩尔质量从而得出A的式量;
6.0g物质A在一定条件下完全分解,生成3.36L(标准状况)一氧化碳和1.8g H2O,CO的物质的量为:$\frac{3.36L}{22.4L/mol}$=0.15mol,水的物质的量为:$\frac{1.8g}{18g/mol}$=0.1mol,
根据元素守恒可知6.0gA含有:0.15molC、0.2molH,则O原子的物质的量为:$\frac{6.0g-12g/mol×0.15mol-1g/mol×0.2mol}{16g/mol}$=0.25mol,
根据质量守恒定律可确定A的分子式;
(2)1mol物质A完全转化为酯,需乙醇2mol,则A分子中含有2个-COOH;1mol物质A能与足量钠反应放出1.5mol的氢气,则1molA提供3mol生成氢气的H原子,则A分子中还含有1个-OH,据此确定其结构简式.
解答 解:(1)1mol物质A完全转化为酯,需乙醇2mol,则A分子中含有2个-COOH;完全中和24g物质A,需要消耗NaOH为0.4mol,则24gA的物质的量为0.2mol,有机物A的摩尔质量为:$\frac{24g}{0.2mol}$=120g/mol,则A的式量为120;
6.0g物质A在一定条件下完全分解,生成3.36L(标准状况)一氧化碳和1.8g H2O,CO的物质的量为:$\frac{3.36L}{22.4L/mol}$=0.15mol,水的物质的量为:$\frac{1.8g}{18g/mol}$=0.1mol,
根据元素守恒可知6.0gA含有:0.15molC、0.2molH,则O原子的物质的量为:$\frac{6.0g-12g/mol×0.15mol-1g/mol×0.2mol}{16g/mol}$=0.25mol,
6.0gA的物质的量为$\frac{6.0g}{120g/mol}$=0.05mol,根据元素守恒可知0.05molA含有0.15molC、0.2molH、0.25molO,
故1molA含有3molC、4molH、5molO原子,有机物A的分子式为:C3H4O5,
答:有机物A的式量为120,化学式为C3H4O5;
(2)1mol物质A完全转化为酯,需乙醇2mol,则A分子中含有2个-COOH;
1mol物质A能与足量钠反应放出1.5mol的氢气,则1molA提供3mol生成氢气的H原子,所以有机物中还含有1个-OH,
所以A分子中含有2个羧基、1个羟基,则有机物A的结构简式为: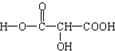 ,
,
答:有机物A的结构简式为 .
.
点评 本题考查有机物的推断、有机物的性质等,题目难度中等,根据性质推断有机物的官能团与数目结合核磁共振氢谱确定有机物的分子式是解题的关键,试题侧重考查学生的分析、理解能力及化学计算能力.

 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案| A. | 0.3 mol•L-1的Na2SO4溶液中含有Na+和SO42-的总物质的量为0.9 mol | |
| B. | 当1 L水吸收22.4 L HCl时所得的盐酸浓度不是1 mol/L,只有当22.4 L HCl溶于水制得1 L盐酸时,其浓度才是1 mol/L | |
| C. | 在K2SO4和NaCl的中性混合水溶液中,如果Na+和SO42-的物质的量相等,则K+和Cl-的物质的量浓度一定相同 | |
| D. | 10℃时,100 mL 0.35 mol/L的KCl饱和溶液蒸发掉5 g水,冷却到10℃时,其体积小于100 mL,它的物质的量浓度仍为0.35 mol/L |
| A. | 电镀铜时,电解质溶液中铜离子浓度不断减小 | |
| B. | 电解精炼铜时,电解质溶液中铜离子浓度不变 | |
| C. | 纯锌与稀硫酸反应时,加入少量CuSO4溶液,会使反应速率减慢 | |
| D. | 要使电解后的CuSO4溶液复原,可向其中加人CuO固体 |
(1)N2、O2和H2相互之间可以发生化合反应,已知反应的热化学方程式如下:
N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1;
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•mol-1;
N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ•mol-1.
则氨的催化氧化反应的热化学方程式为4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905kJ/mol.
(2)汽车尾气净化的一个反应原理为:2NO(g)+2CO(g)?N2(g)+2CO2(g)△H<0.一定温度下,将2.8mol NO、2.4mol CO通入固定容积为2L的密闭容器中,反应过程中部分物质的物质的量变化如图1所示.
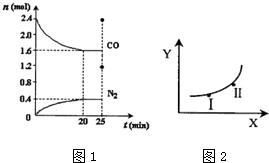
①NO的平衡转化率为28.57%,0~20min平均反应速率v(NO)为0.02mol/(L•min).25min时,若保持反应温度不变,再向容器中充入CO、N2各0.8mol,则化学平衡将向左移动(填“向左”、“向右”或“不”).
②如图2若只改变某一反应条件X,反应由原平衡I达到新平衡Ⅱ,变量Y的变化趋势如表所示.下列说法正确的是b (填字母代号).
| 条件X | 变量Y | |
| a | 压强 | 反应的平衡常数 |
| b | 温度 | CO的平衡浓度 |
| c | 温度 | N2的体积分数 |
| d | 催化剂 | NO的平衡转化率 |
a.放电过程中,电解质溶液的pH保持不变
b.溶液中的NH4Cl浓度增大,但Cl-离子浓度不变
c.每转移6.02×1023个电子,则有标准状况下11.2L电极反应物被氧化
d.为保持放电效果,电池使用一段时间需更换电解质溶液.
实验(一)如图1碘含量的测定

取0.0100mol•Lˉ1的AgNO3标准溶液装入滴定管,取100.00mL海带浸取原液至滴定池,用电势滴定法测定碘含量.测得的电动势(E)反映溶液中c(Iˉ)的变化,部分数据如表:
| V(AgNO3)/mL | 15.00 | 19.00 | 19.80 | 19.98 | 20.00 | 20.02 | 21.00 | 23.00 | 25.00 |
| E/mV | -225 | -200 | -150 | -100 | 50.0 | 175 | 275 | 300 | 325 |
另制海带浸取原液,甲、乙两种实验方案如下:
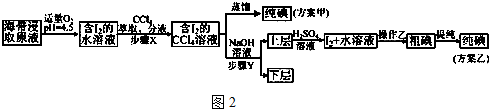
已知:3I2+6NaOH═5NaI+NaIO3+3H2O.请回答:
(1)实验(一)中的仪器名称:仪器A坩埚,仪器B500mL容量瓶.
(2)①根据表中数据绘制滴定曲线如图3:
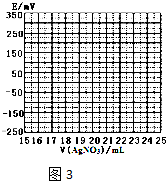
②该次滴定终点时用去AgNO3溶液的体积为20.00mLmL,计算得海带中碘的百分含量为0.635%.
(3)①分液漏斗使用前须检漏,检漏方法为向分液漏斗中加入少量蒸馏水,检查旋塞处是否漏水,将漏斗倒转过来,检查玻璃塞是否漏水.
②步骤X中,萃取后分液漏斗内观察到的现象是液体分为上下两层,下层呈紫红色.
③下列有关步骤Y的说法,正确的是AB.
A.应控制NaOH溶液的浓度和体积 B.将碘转化成离子进入水层
C.主要是除去海带浸取原液中的有机杂质 D.NaOH溶液可以由乙醇代替
④实验(二)中操作乙的名称是过滤.
(4)方案甲中采用蒸馏不合理,理由是碘单质易升华,会导致碘损失.
方案乙中粗碘提纯的方法是升华.
| A. | 0.5 mol 1,3-丁二烯分子中含有C=C双键数为 NA | |
| B. | 1 mol羟基(-OH)所含的电子总数为9NA | |
| C. | 14g乙烯、丙烯的混合气体中所含原子总数为3NA | |
| D. | 标准状况下,1L庚烷完全燃烧所生成的气态产物的分子数为7/22.4NA |
| A. | 2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑ | B. | 4Fe(OH)2+O2+2H2O=4Fe(OH)3 | ||
| C. | 2F2+2H2O=4HF+O2↑ | D. | 2Na+2H2O=2NaOH+H2↑ |
| A. | 用分液漏斗和烧杯分离水和乙酸乙酯的混合物 | |
| B. | 用瓷坩埚熔融烧碱 | |
| C. | 用玻璃棒蘸少量待测物质的浓溶液做焰色反应 | |
| D. | 将pH试纸直接插入溶液中测量某溶液pH |
CO(g)+2H2(g)?CH3OH(g);△H
(1)判断反应达到平衡状态的依据是(填字母序号,下同)CD.
A.生成CH3OH的速率与消耗CO的速率相等 B.混合气体的密度不变
C.混合气体的平均相对分子质量不变 D.CH3OH、CO、H2的浓度都不再发生变化
(2)下表所列数据是反应在不同温度下的化学平衡常数(K)
| 温度 | 250℃ | 300℃ | 35℃ |
| K | 2.041 | 0.270 | 0.012 |
(3)要提髙CO的转化率,可以采取的措施是df.
a.升温b.加人催化剂 c.增加CO的浓度 d.加入H2加压e.加人惰性气体加压 f.分离出甲醇
(4)300℃时,在一定的压强下,5mol CO与足量的H2在催化剂的作用下恰好完全反应变 化的热量为454KJ.在该温度时,在容积相同的3个密闭容器中,按不同方式投人反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 | 甲 | 乙 | 丙 | |
| 反应物投入量 | 1molCO 2molH2 | 2mol CH3OH | 2mol CH3OH | |
| 平 均 数 据 | CH3OH的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | aKJ | bKJ | cKJ | |
| 体系压强 | P1 | P2 | P3 | |
| 反转化率应物 | a1 | a2 | a3 | |