题目内容
根据反应8NH3+3Cl2=6NH4Cl+N2,回答下列问题.
(1)氧化剂 ,氧化产物 .
(2)被氧化与被还原的原子数之比为 .
(3)当生成28gN2时,被氧化的物质的质量是 g.
(4)当反应过程中有3mol电子转移时,参加反应的NH3的物质的量为 mol.
(5)用双线桥法标明电子转移的方向和数目 .
(1)氧化剂
(2)被氧化与被还原的原子数之比为
(3)当生成28gN2时,被氧化的物质的质量是
(4)当反应过程中有3mol电子转移时,参加反应的NH3的物质的量为
(5)用双线桥法标明电子转移的方向和数目
考点:氧化还原反应
专题:氧化还原反应专题
分析:该反应中N元素化合价由-3价变为0价、Cl元素化合价由0价变为-1价,所以NH3是还原剂、Cl2是氧化剂,再结合氮气和还原剂之间的关系式计算被氧化的物质的质量.
解答:
解:(1)该反应中N元素化合价由-3价变为0价、Cl元素化合价由0价变为-1价,所以NH3是还原剂、Cl2是氧化剂,N2为氧化产物,故答案为:Cl2;N2;
(2)由方程式可知,当有8mol氨气参加反应,有2mol被氧化,同时有3mol氯气参加反应,则被氧化与被还原的原子数之比为1:3,故答案为:1:3;
(3)当生成28gN2时,氮气的物质的量=
=1mol,根据氮原子守恒知,被氧化的氨气的物质的量是2mol,则被氧化的氨气的质量=2mol×17g/mol=34g,
故答案为:34;
(4)N元素化合价由-3价升高0价,在当反应过程中有3mol电子转移时,有0.5mol氮气生成,则消耗4mol氨气,故答案为:4;
(5)用双线桥标出电子转移的方向和数目可为 ,故答案为:
,故答案为: .
.
(2)由方程式可知,当有8mol氨气参加反应,有2mol被氧化,同时有3mol氯气参加反应,则被氧化与被还原的原子数之比为1:3,故答案为:1:3;
(3)当生成28gN2时,氮气的物质的量=
| 28g |
| 28g/mol |
故答案为:34;
(4)N元素化合价由-3价升高0价,在当反应过程中有3mol电子转移时,有0.5mol氮气生成,则消耗4mol氨气,故答案为:4;
(5)用双线桥标出电子转移的方向和数目可为
 ,故答案为:
,故答案为: .
.
点评:本题考查氧化还原反应,为高考高频考点,把握发生的化学反应及反应中元素的化合价变化为解答的关键,侧重基本概念和转移电子的考查,题目难度不大.

练习册系列答案
相关题目
某有机物的结构简式为:
①可以燃烧②能使酸性高锰酸钾溶液褪色③能与NaOH溶液反应④能发生消去反应⑤能发生加聚反应( )

①可以燃烧②能使酸性高锰酸钾溶液褪色③能与NaOH溶液反应④能发生消去反应⑤能发生加聚反应( )
| A、只有①③ | B、只有②④⑤ |
| C、除③外 | D、全部 |
美国哥伦比亚大学的科学家根据对沉积物中稀土元素钕(Nd)的分析发现,北大西洋和太平洋海水中的
Nd和
Nd比例差异很明显,由此得出周围大陆的岩石中
Nd和
Nd含量不同的结论.下列有关说法正确的是( )
143 60 |
144 60 |
143 60 |
144 60 |
A、
| ||||
B、因各地岩石中
| ||||
C、
| ||||
| D、Nd是镧系元素,镧系元素都互为同位素 |
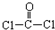 ,每个COCl2分子内含有
,每个COCl2分子内含有
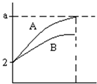 pH=2的A、B两种酸溶液各1mL,分别加水稀释到1000mL,其pH与溶液体积的关系如图所示,回答下列问题:
pH=2的A、B两种酸溶液各1mL,分别加水稀释到1000mL,其pH与溶液体积的关系如图所示,回答下列问题: 如图,拴上金属条的铁钉插在含有酚酞的NaCl溶液中,可以看到在贴近金属条一边的溶液出现粉红色.该金属条可能是( )
如图,拴上金属条的铁钉插在含有酚酞的NaCl溶液中,可以看到在贴近金属条一边的溶液出现粉红色.该金属条可能是( )