题目内容
实验室中需要配制500mL 0.10mol/L的NaOH溶液,就该实验回答下列问题.
(1)用托盘天平称取NaOH固体 g.称量NaOH固体需注意:因NaOH具有腐蚀性,在称量时需用烧杯盛装NaOH固体;称量必须迅速,其原因是 .
(2)接下来完成此实验你将用到的仪器有玻璃棒、烧杯、 .
而某同学提出只需再选择带刻度的500mL烧杯和玻璃棒,即可配制500mL 0.10mol/L的NaOH溶液;你对此方案的评价是 .
(3)若你从所配的溶液中取出50mL于一试剂瓶中,请给它贴上标签,标签的内容是 ;若再从中取出10mL溶液加水稀释至20mL,则此时溶液的物质的量浓度为 .
(4)下列操作对所配溶液浓度没有影响的是 .
A.称量时已观察到NaOH表面潮湿
B.将烧杯中溶解后的溶液立即注入容量瓶,然后再添加蒸馏水至刻度线
C.摇匀定容后,又用胶头滴管向容量瓶中滴加蒸馏水至刻度线
D.配制溶液前用蒸馏水润洗容量瓶,但未烘干.
(1)用托盘天平称取NaOH固体
(2)接下来完成此实验你将用到的仪器有玻璃棒、烧杯、
而某同学提出只需再选择带刻度的500mL烧杯和玻璃棒,即可配制500mL 0.10mol/L的NaOH溶液;你对此方案的评价是
(3)若你从所配的溶液中取出50mL于一试剂瓶中,请给它贴上标签,标签的内容是
(4)下列操作对所配溶液浓度没有影响的是
A.称量时已观察到NaOH表面潮湿
B.将烧杯中溶解后的溶液立即注入容量瓶,然后再添加蒸馏水至刻度线
C.摇匀定容后,又用胶头滴管向容量瓶中滴加蒸馏水至刻度线
D.配制溶液前用蒸馏水润洗容量瓶,但未烘干.
考点:配制一定物质的量浓度的溶液
专题:实验题
分析:(1)利用n=cv计算出氢氧化钠的物质的量,再根据m=nM计算所需氢氧化钠的质量;腐蚀性易潮解的药品应放在玻璃器皿内迅速称量;
(2)根据配制500mL 0.10mol/L的NaOH溶液的步骤结合各仪器的作用选取仪器;根据500mL烧杯的最小读数为0.1mL,配制的溶液浓度只能为0.1mol/L,无法达到0.01mol/L;
(3)标签上需要注明溶液的名称、溶液的物质的量浓度;溶液的浓度与溶液的体积成反比,据此计算出稀释后溶液的浓度;
(4)根据c=
可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量n和溶液的体积V引起的,误差分析时,关键要看配制过程中引起n和V怎样的变化:若n比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若n比理论值大,或V比理论值小时,都会使所配溶液浓度偏大.
(2)根据配制500mL 0.10mol/L的NaOH溶液的步骤结合各仪器的作用选取仪器;根据500mL烧杯的最小读数为0.1mL,配制的溶液浓度只能为0.1mol/L,无法达到0.01mol/L;
(3)标签上需要注明溶液的名称、溶液的物质的量浓度;溶液的浓度与溶液的体积成反比,据此计算出稀释后溶液的浓度;
(4)根据c=
| n |
| V |
解答:
解:(1)需氢氧化钠的质量为:m(NaOH)=0.5L×0.1mol?L-1×40g/mol=2.0g;
氢氧化钠有腐蚀性易潮解应放在小烧杯内迅速称量,防止称量时间过长,NaOH吸水,
故答案为:2.0;防止称量时间过长,NaOH吸水;
(2)配制500mL的氢氧化钠溶液,需要选用500mL容量瓶,定容时必须使用胶头滴管定容,所以还缺少500mL容量瓶、胶头滴管;
选择带刻度的500mL烧杯和玻璃棒配制NaOH溶液,由于500mL烧杯所量体积并不精确,该同学所配溶液的浓度只是约为0.1 mol/L,
故答案为:500mL容量瓶、胶头滴管;由于500mL烧杯所量体积并不精确,该同学所配溶液的浓度只是约为0.1 mol/L;
(3)从所配的溶液中取出50mL于一试剂瓶中,标签上应该注明溶液的名称及浓度,该氢氧化钠溶液的标签的内容为:0.10 mol/L NaOH(aq);
若再从中取出10mL溶液加水稀释至20mL,根据n=cV可知,浓度与溶液的体积成反比,体积扩大为原先的2倍,则此时溶液的物质的量浓度为0.01mol/L×
=0.05mol/L,
故答案为:0.10 mol/L NaOH(aq);0.05 mol/L;
(4)A.称量时已观察到NaOH表面潮湿,导致配制的溶液中氢氧化钠的物质的量偏小,配制的溶液浓度偏低,故A错误;
B.将烧杯中溶解后的溶液立即注入容量瓶,然后再添加蒸馏水至刻度线,没有冷却,热的溶液体积偏大,冷却后溶液体积变小,导致配制的溶液体积偏小,配制的溶液浓度偏高,故B错误;
C.摇匀定容后,又用胶头滴管向容量瓶中滴加蒸馏水至刻度线,大骗子加入的蒸馏水体积偏大,配制的溶液体积偏大,溶液浓度偏低,故C错误;
D.配制溶液前用蒸馏水润洗容量瓶,但未烘干,对溶质的物质的量及溶液的体积都没有影响,所以不影响配制结果,故D正确;
故答案为:D.
氢氧化钠有腐蚀性易潮解应放在小烧杯内迅速称量,防止称量时间过长,NaOH吸水,
故答案为:2.0;防止称量时间过长,NaOH吸水;
(2)配制500mL的氢氧化钠溶液,需要选用500mL容量瓶,定容时必须使用胶头滴管定容,所以还缺少500mL容量瓶、胶头滴管;
选择带刻度的500mL烧杯和玻璃棒配制NaOH溶液,由于500mL烧杯所量体积并不精确,该同学所配溶液的浓度只是约为0.1 mol/L,
故答案为:500mL容量瓶、胶头滴管;由于500mL烧杯所量体积并不精确,该同学所配溶液的浓度只是约为0.1 mol/L;
(3)从所配的溶液中取出50mL于一试剂瓶中,标签上应该注明溶液的名称及浓度,该氢氧化钠溶液的标签的内容为:0.10 mol/L NaOH(aq);
若再从中取出10mL溶液加水稀释至20mL,根据n=cV可知,浓度与溶液的体积成反比,体积扩大为原先的2倍,则此时溶液的物质的量浓度为0.01mol/L×
| 1 |
| 2 |
故答案为:0.10 mol/L NaOH(aq);0.05 mol/L;
(4)A.称量时已观察到NaOH表面潮湿,导致配制的溶液中氢氧化钠的物质的量偏小,配制的溶液浓度偏低,故A错误;
B.将烧杯中溶解后的溶液立即注入容量瓶,然后再添加蒸馏水至刻度线,没有冷却,热的溶液体积偏大,冷却后溶液体积变小,导致配制的溶液体积偏小,配制的溶液浓度偏高,故B错误;
C.摇匀定容后,又用胶头滴管向容量瓶中滴加蒸馏水至刻度线,大骗子加入的蒸馏水体积偏大,配制的溶液体积偏大,溶液浓度偏低,故C错误;
D.配制溶液前用蒸馏水润洗容量瓶,但未烘干,对溶质的物质的量及溶液的体积都没有影响,所以不影响配制结果,故D正确;
故答案为:D.
点评:本题考查了配制一定物质的量浓度的溶液的方法,该题难度中等,注意掌握配制一定物质的量浓度的溶液的方法,试题侧重对学生能力的培养和解题方法的指导和训练,有利于培养学生的逻辑思维能力和严谨的规范实验操作能力.

练习册系列答案
相关题目
豪猪烯(hericenes),形状宛如伏地伸刺的动物,其键线式如图.下列有关豪猪烯的说法正确的是( )
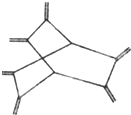

| A、豪猪烯与乙烯互为同系物 |
| B、豪猪烯分子中所有原子在同一平面 |
| C、豪猪烯的分子式为:C14H20 |
| D、豪猪烯能使酸性高锰酸钾溶液褪色 |
在盛放酒精的试剂瓶的标签上应印有的警示标志是( )
A、 |
B、 |
C、 |
D、 |
分离 FeCl3、KCl、CaCO3的固体混合物,应采用的一组试剂是( )
| A、水、硝酸银、稀硝酸 |
| B、水、氢氧化钠、盐酸 |
| C、水、氢氧化钾、盐酸 |
| D、水、氢氧化钾、硫酸 |
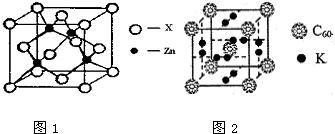 [化学-选修3:物质结构与性质]
[化学-选修3:物质结构与性质] (1)在25℃、101kPa下,1g甲烷完全燃烧生成CO2和液态H2O,放出55kJ的热量,写出表示甲烷燃烧热的热化学方程式:
(1)在25℃、101kPa下,1g甲烷完全燃烧生成CO2和液态H2O,放出55kJ的热量,写出表示甲烷燃烧热的热化学方程式: