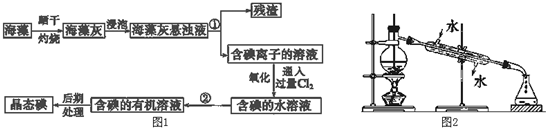
题目内容
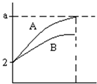 pH=2的A、B两种酸溶液各1mL,分别加水稀释到1000mL,其pH与溶液体积的关系如图所示,回答下列问题:
pH=2的A、B两种酸溶液各1mL,分别加水稀释到1000mL,其pH与溶液体积的关系如图所示,回答下列问题:(1)若a=5,则A为
(2)若A、B都是弱酸,则a的范围是
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:稀释弱酸时促进弱酸电离,则稀释过程中pH变化越大的酸的酸性越强,变化越小的酸性越弱,无限稀释酸时,酸溶液的pH接近中性.
解答:
解:(1)稀释弱酸时促进弱酸电离,则稀释过程中pH变化越大的酸的酸性越强,变化越小的酸性越弱,根据图象知,A是强酸、B是弱酸,若再稀释100倍,酸溶液仍然呈酸性,但接近中性,所以A的pH<7,
故答案为:强;弱;<;
(2)若A、B都是弱酸,加水稀释促进弱酸电离,所以稀释1000倍后,溶液中氢离子浓度大于原来的
,所以该溶液的pH范围为:2<a<5,故答案为:2<a<5.
故答案为:强;弱;<;
(2)若A、B都是弱酸,加水稀释促进弱酸电离,所以稀释1000倍后,溶液中氢离子浓度大于原来的
| 1 |
| 1000 |
点评:本题考查了弱电解质的电离,明确弱电解质的电离特点是解本题关键,加水稀释促进弱电解质电离,根据pH变化确定酸的强弱,题目难度不大.

练习册系列答案
 巧学巧练系列答案
巧学巧练系列答案 课课练江苏系列答案
课课练江苏系列答案
相关题目
下列表示对应化学反应的离子方程式正确的是( )
A、向银氨溶液中滴加乙醛:CH3CHO+2[Ag(NH3)2]++H2O
| ||
B、苯酚钠溶液中通入少量CO2: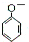 +H2O+CO2→ +H2O+CO2→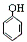 +HCO3- +HCO3- | ||
| C、硫酸氢铵溶液中滴加少量NaOH溶液:H++NH4++2OH-═NH3?H2O+H2O | ||
| D、氯乙酸与足量的氢氧化钠溶液共热:CH2ClCOOH+OH-→CH2ClCOO-+H2O |
卤代烃能发生下列反应:2CH3CH2Br+2Na→CH3CH2CH2CH3+2NaBr下列有机物可以合成环丙烷的是( )
| A、CH3CH2CH2Br |
| B、CH3CHBrCH2Br |
| C、CH2BrCH2CH2Br |
| D、CH3CHBrCH2CH2Br |
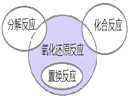 氧化还原反应与四种基本反应类型的关系如图所示.下列化学反应属于阴影部分
氧化还原反应与四种基本反应类型的关系如图所示.下列化学反应属于阴影部分的是( )
| A、4Fe(OH)2+O2+2H2O=4Fe(OH)3 | ||||
B、4NH3+5O2
| ||||
| C、2NaHCO3=Na2CO3+H2O+CO2↑ | ||||
| D、Cl2+2NaBr=2NaCl+Br2 |

 (1)在25℃、101kPa下,1g甲烷完全燃烧生成CO2和液态H2O,放出55kJ的热量,写出表示甲烷燃烧热的热化学方程式:
(1)在25℃、101kPa下,1g甲烷完全燃烧生成CO2和液态H2O,放出55kJ的热量,写出表示甲烷燃烧热的热化学方程式: 实验室配制欲配制480mL4.0mol?L-1的NaOH溶液.根据配置溶液的具体过程回答下列问题:
实验室配制欲配制480mL4.0mol?L-1的NaOH溶液.根据配置溶液的具体过程回答下列问题: