题目内容
3.金属和非金属及其化合物在日常生产生活中有着广泛的运用,请回答下列问题:(1)硅单质、硅的氧化物、硅酸盐产品在日常生活中广泛的运用:
①硅在周期表中的位置:第三周期第 IVA族
②硅酸钠是为数不多的溶于水的硅酸盐,硅酸钠显碱性,向硅酸钠溶液中通入足量CO2有白色沉淀产生,写出该反应的离子反应方程式:SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-
(2)铜不能与稀硫酸共热发生反应,但在过氧化氢与稀硫酸的混合溶液中加入铜片,常温下就生成蓝色溶液.写出有关反应的化学方程式:Cu+H2O2+H2SO4═CuSO4+2H2O.硫酸在该反应中表现的性质是酸性.
(3)纳米金属铁能高效地降解毒性强、难生物降解的有机卤化物,科技工作者利用Fe2O3和CH4在一定条件下制得纳米级单质铁,同时两种可燃性气体,则该反应的化学反应方程式为:Fe2O3+3CH4$\frac{\underline{\;一定条件\;}}{\;}$2Fe+CO+6H2
(4)Fe3O4是磁铁矿的主要成分,Fe3O4可用于制造录音磁带和电讯器材等.高温下,铝粉能与Fe3O4发生铝热反应,该反应的化学方程式为8Al+3Fe3O4$\frac{\underline{\;高温\;}}{\;}$4Al2O3+9Fe.34.8g Fe3O4与足量稀硝酸反应,被还原HNO3的物质的量为0.05mol.
分析 (1)①Si原子核外电子分三层排布,最外层有4个;
②强碱弱酸盐在溶液中水解显碱性;硅酸钠溶液与二氧化碳反应生成硅酸和碳酸氢钠;
(2)加热条件下,铜、氧气和稀硫酸反应生成硫酸铜和水;根据硫酸中元素化合价是否变化确定硫酸性质;
(3)Fe2O3和CH4在一定条件下制得纳米级单质铁,同时两种可燃性气体,由反应物中的元素可知,另外产物为氢气和CO;
(4)高温下,铝粉能与Fe3O4发生铝热反应生成Al2O3与Fe;Fe3O4相当于FeO.Fe2O3,被还原的HNO3转化为NO,根据电子转移守恒计算.
解答 解:(1)①Si原子核外电子分三层排布,最外层有4个,已知电子层数等于主族的族序数,电子层数等于周期数,所以硅在周期表中的位置:第三周期第 IVA族;
故答案为:第三周期第IVA族;
②硅酸钠是强碱弱酸盐在溶液中水解显碱性;硅酸钠溶液与足量的二氧化碳反应生成硅酸和碳酸氢钠,其反应的离子方程式为:SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-;
故答案为:SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-;
(2)在过氧化氢与稀硫酸的混合溶液中加入铜片,铜、过氧化氢和稀硫酸反应生成硫酸铜和水,反应方程式为:Cu+H2O2+H2SO4═CuSO4+2H2O,该反应中硫酸中各元素化合价不变,所以硫酸体现酸性,
故答案为:Cu+H2O2+H2SO4═CuSO4+2H2O;酸性;
(3)Fe2O3和CH4在一定条件下制得纳米级单质铁,同时两种可燃性气体,由反应物中的元素可知,另外产物为氢气和CO,其反应方程式为:Fe2O3+3CH4$\frac{\underline{\;一定条件\;}}{\;}$2Fe+CO+6H2;
故答案为:Fe2O3+3CH4$\frac{\underline{\;一定条件\;}}{\;}$2Fe+CO+6H2;
(4)高温下,铝粉能与Fe3O4发生铝热反应生成Al2O3与Fe,反应方程式为:8Al+3Fe3O4$\frac{\underline{\;高温\;}}{\;}$4Al2O3+9Fe,
34.8g Fe3O4的物质的量为$\frac{34.8g}{232g/mol}$=0.15mol,Fe3O4相当于FeO.Fe2O3,被还原的HNO3转化为NO,根据电子转移守恒,被还原的HNO3的物质的量为$\frac{0.15mol×(3-2)}{5-2}$=0.05mol,
故答案为:8Al+3Fe3O4$\frac{\underline{\;高温\;}}{\;}$4Al2O3+9Fe;0.05.
点评 本题考查元素化合物的性质、氧化还原反应计算、盐的水解原理的应用等,属于拼合型题目,侧重考查学生分析计算能力以及对知识的迁移运用,难度中等.

| A. | 液氨可用作制冷剂是因为其气化时可放出大量的热 | |
| B. | 将青蒿在乙醚中浸取,通过分馏可提取治疗疟疾的青蒿素 | |
| C. | 钢制品、铝制品在日常生活中被广泛应用是因为铁、铝为活泼金属 | |
| D. | 久置的漂白粉变质是因为漂白粉与空气中的O2反应 |
| 选项 | 化学性质 | 实际应用 |
| A | ClO2具有强氧化性 | 自来水消毒杀菌 |
| B | SO2具有还原性 | 用作漂白剂 |
| C | NaHCO3受热易分解并且生成气体 | 焙制糕点 |
| D | Al(OH)3分解吸收大量热量并有H2O生成 | 阻燃剂 |
| A. | A | B. | B | C. | C | D. | D |
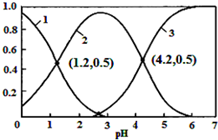 已知H2SO3?HSO3-+H+,Ka1;HSO3-?SO32-+H+,Ka2.常温下,向某浓度的H2SO3溶液中逐滴加入一定量浓度的NaOH溶液,所得溶液中H2SO3、HSO3-、SO32-三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是( )
已知H2SO3?HSO3-+H+,Ka1;HSO3-?SO32-+H+,Ka2.常温下,向某浓度的H2SO3溶液中逐滴加入一定量浓度的NaOH溶液,所得溶液中H2SO3、HSO3-、SO32-三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是( )| A. | pH=1.2溶液中:c(Na+)+c(H+)═c(OH-)+c(H2SO3) | |
| B. | 常温下,$\frac{{c}^{2}(HS{{O}_{3}}^{-})}{c({H}_{2}S{O}_{3})•c(S{{O}_{3}}^{2-})}$=1000 | |
| C. | 向pH=1.2的溶液中加KOH溶液将pH增大至4.2的过程中水的电离度先增大后减小 | |
| D. | 曲线3表示的微粒是SO32- |
| A. | .正常条件下,pH值小于5.6的降雨是“酸雨” | |
| B. | 冰岛火山喷发含有大量SO2,在局部区域形成酸雨 | |
| C. | 全球“低碳”行动能减少CO2排放量,也就能降低酸雨的形成及危害 | |
| D. | 汽车尾气含有氮氧化合物,过量排放形成酸雨 |
| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 0.60 | 0.30 |
| t1 | 0.40 | |
| t2 | 0.10 |
| A. | 反应在t1min内的平均速率为v(H2)=0.20/t1mol•L-1•min-1 | |
| B. | 保持其他条件不变,向平衡体系中再通入0.10molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减小 | |
| C. | 温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应 | |
| D. | 700℃时,若向密闭容器中充入CO(g)、H2O(g)、CO2(g)、H2(g)的物质的量分别为0.60mol、1.00mol、0.60mol、0.60mol,则此时该反应v(正)<v(逆) |
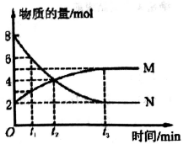 一定温度下,在体积为2L的密闭容器中通入气体M和N并发生反应,物质的量随时间的变化关系如图.下列说法正确的是( )
一定温度下,在体积为2L的密闭容器中通入气体M和N并发生反应,物质的量随时间的变化关系如图.下列说法正确的是( )| A. | M、N之间转化的反应方程式为M=2N | |
| B. | t2时刻,反应达到平衡,正、逆反应速率达到相等 | |
| C. | t3时刻,M的反应速率为$\frac{3}{2{t}_{3}}$mol•L-1•min-l | |
| D. | t1时刻,在容器内气体M和N的物质的量浓度之比为1:2 |
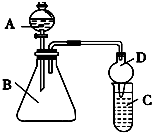 某同学为探究元素周期表中元素性质的递变规律,设计了如下实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下实验.