题目内容
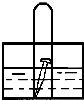 如图,水槽中试管内有一枚铁钉,放置数天观察,铁钉有明显生锈的迹象:
如图,水槽中试管内有一枚铁钉,放置数天观察,铁钉有明显生锈的迹象:(1)若试管内液面上升,则溶液呈
(2)若试管内液面下降,则溶液呈
考点:金属的电化学腐蚀与防护
专题:
分析:生铁中含有碳,铁、碳和合适的电解质溶液构成原电池,在弱酸性或中性条件下,铁发生吸氧腐蚀,负极上铁失电子发生氧化反应,正极上氧气得电子和水反应生成氢氧根离子,在酸性条件下,铁发生析氢腐蚀,负极上铁失电子发生氧化反应,正极上氢离子得电子发生还原反应.
解答:
解:生铁中含有碳,铁、碳和合适的电解质溶液构成原电池,
(1)若试管内液面上升,说明电解质环境是弱酸性或是中性,试管内气体因和水反应而使其压强减小,发生的是吸氧腐蚀,铁作负极,负极上铁失电子发生氧化反应,电极反应式为:Fe-2e-═Fe2+,正极上氧气得电子发生还原反应,电极反应式为2H2O+O2+4e-═4OH-,
故答案为:弱酸性或是中性;2H2O+O2+4e-═4OH-;
(2)若试管内液面下降,说明金属的腐蚀中生成气体导致压强增大,则金属发生的是析氢腐蚀,溶液呈酸性,负极上铁失电子发生氧化反应,电极反应式为:Fe-2e-═Fe2+,正极上氢离子得电子发生还原反应,电极反应式为:4H++4e-═2H2↑,
故答案为:较强的酸;4H++4e-═2H2↑.
(1)若试管内液面上升,说明电解质环境是弱酸性或是中性,试管内气体因和水反应而使其压强减小,发生的是吸氧腐蚀,铁作负极,负极上铁失电子发生氧化反应,电极反应式为:Fe-2e-═Fe2+,正极上氧气得电子发生还原反应,电极反应式为2H2O+O2+4e-═4OH-,
故答案为:弱酸性或是中性;2H2O+O2+4e-═4OH-;
(2)若试管内液面下降,说明金属的腐蚀中生成气体导致压强增大,则金属发生的是析氢腐蚀,溶液呈酸性,负极上铁失电子发生氧化反应,电极反应式为:Fe-2e-═Fe2+,正极上氢离子得电子发生还原反应,电极反应式为:4H++4e-═2H2↑,
故答案为:较强的酸;4H++4e-═2H2↑.
点评:本题考查了钢铁的电化学腐蚀,注意酸性条件下钢铁发生析氢腐蚀,弱酸性或中性条件下钢铁发生吸氧腐蚀.

练习册系列答案
相关题目
在无色透明的强酸性溶液中,能大量共存的是( )
| A、Ca2+、K+、HCO3-、Na+ |
| B、Fe3+、Cl-、H+、NO3- |
| C、Mg2+、Na+、NO3-、Cl- |
| D、K+、OH-、Cl-、SO42- |
下列叙述中,不正确的是( )
| A、氯水中的次氯酸具有杀菌消毒作用 |
| B、陶瓷的主要成分是碳酸钙 |
| C、硅是制造太阳能电池的常用材料 |
| D、漂白粉的有效成分是次氯酸钙 |
将20mL 0.5mol?L-1K2SO3溶液逐滴加入到20mL 0.2mol?L-1 硫酸酸化的紫色KMnO4溶液中,溶液恰好变为无色.则Mn元素在产物中的存在形态是( )
| A、Mn |
| B、Mn2+ |
| C、Mn2O3 |
| D、K2MnO4 |
如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中,下列分析正确的是( )
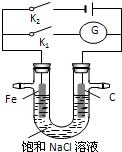

| A、K1闭合,铁棒上发生的反应为2H++2e-→H2↑ |
| B、K1闭合,石墨棒周围溶液pH逐渐升高 |
| C、K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法 |
| D、K2闭合,电路中通过0.4NA个电子时,两极共产生标况下4.48L气体 |
下列有关原电池的说法正确的是( )
| A、失去电子的极是正极 |
| B、正极发生氧化反应 |
| C、电子从正极流向负极 |
| D、发生氧化反应的是负极 |
CaH2常作生氢剂.对于反应CaH2+2H2O=Ca(OH)2+2H2↑,有如下判断:上述判断中正确的是( )
①H2只是氧化产物;
②H2既是氧化产物,又是还原产物;
③H2O是氧化剂
④CaH2是氧化剂;
⑤此反应中的氧化产物与还原产物的分子数之比是1:1.
①H2只是氧化产物;
②H2既是氧化产物,又是还原产物;
③H2O是氧化剂
④CaH2是氧化剂;
⑤此反应中的氧化产物与还原产物的分子数之比是1:1.
| A、①④⑤ | B、②③④ |
| C、③④⑤ | D、②③⑤ |
下列说法正确的是( )
| A、标准状况下,1mol H2O和1mol H2的体积都约为22.4L |
| B、1molNa2CO3 中Na+ 的物质的量为1mol |
| C、1mol某气体的体积为22.4L |
| D、标准状况下,1g H2和 11.2LO2的物质的量相等 |