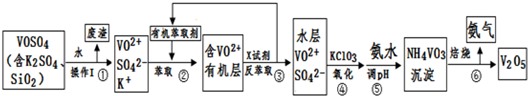
题目内容
CaH2常作生氢剂.对于反应CaH2+2H2O=Ca(OH)2+2H2↑,有如下判断:上述判断中正确的是( )
①H2只是氧化产物;
②H2既是氧化产物,又是还原产物;
③H2O是氧化剂
④CaH2是氧化剂;
⑤此反应中的氧化产物与还原产物的分子数之比是1:1.
①H2只是氧化产物;
②H2既是氧化产物,又是还原产物;
③H2O是氧化剂
④CaH2是氧化剂;
⑤此反应中的氧化产物与还原产物的分子数之比是1:1.
| A、①④⑤ | B、②③④ |
| C、③④⑤ | D、②③⑤ |
考点:氧化还原反应
专题:氧化还原反应专题
分析:反应CaH2+2H2O=Ca(OH)2+2H2↑,是氧化还原反应,标注化合价的变化,依据基本概念进行分析判断;化合价升高的元素具有还原性被氧化为氧化产物,化合价降低的元素具有氧化性被还原为还原产物,氧化还原反应中得失电子守恒.
解答:
解:反应中CaH2中氢元素从-1价变化为0价,做还原剂被氧化为氢气;H2O中氢原子化合价从+1价变化为0价,做氧化剂被还原为H2;
①氢气是氧化产物和还原产物,故①错误;
②氢气是氧化产物和还原产物,故②正确;
③H2O是氧化剂,故③正确;
④CaH2中的氢元素被氧化,为还原剂故④错误;
⑤反应中的氧化产物与还原产物的分子个数之比为1:1,故⑤正确;
综上所述:②③⑤正确;
故选D.
①氢气是氧化产物和还原产物,故①错误;
②氢气是氧化产物和还原产物,故②正确;
③H2O是氧化剂,故③正确;
④CaH2中的氢元素被氧化,为还原剂故④错误;
⑤反应中的氧化产物与还原产物的分子个数之比为1:1,故⑤正确;
综上所述:②③⑤正确;
故选D.
点评:本题考查了氧化还原反应的概念分析判断,为高频考点,侧重于基本概念的理解和运用的考查,注意氧化产物,还原产物的判断和计算,关键是正确标注元素化合价,题目难度不大.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目
茶叶中铁元素的检验可经过以下四个步骤完成,各步骤中选用的实验用品正确且完整是( )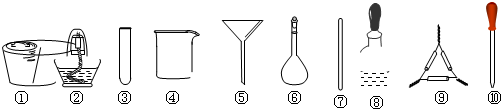

| A、将茶叶灼烧灰化,选用①、② |
| B、用浓硝酸溶解茶叶灰并加蒸馏水稀释,选用④、⑥和⑦ |
| C、过滤得到的滤液,选用④、⑤ |
| D、检验滤液中的Fe3+,选用③、⑧、⑩ |
下列物质的水溶液能够导电,但属于非电解质的是( )
| A、H2S |
| B、碳酸氢钠 |
| C、氨气 |
| D、氢氧化钾 |
下列解释事实的化学用语不正确的是( )
| A、生活中用纯碱做洗涤剂的原理:CO32-+H2O?HCO3-+OH- |
| B、已知某温度和压强下,将0.5molN2和1.5mol H2置于密闭容器中充分反应生成NH3(g)放热19.3KJ,故有:N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ?mol-1 |
| C、“NO2球”浸泡在冷水中,颜色变浅:2NO2(g)?N2O4(g)△H<0 |
| D、NaHSO3溶液呈酸性:HSO3-+H2O?SO32-+H3O+ |
在以离子键为主的化学键中常含有共价键的成分,下列各对原子形成化学键中共价键成分最少的是( )
| A、Cl,F | B、Na,F |
| C、Na,Cl | D、Mg,O |
在一定温度下,CO和CH4燃烧的热化学方程式分别为:2CO(g)+O2(g)═2CO2(g)△H=-566kJ/mol
CH4(g)+O2(g)═
CO2(g)+H2O(l)△H=-445kJ/mol,1molCO和2mol CH4组成的混合气体,在相同条件下完全燃烧时,释放的热量为( )
| 1 |
| 2 |
| 1 |
| 2 |
| A、2346 kJ |
| B、2670 kJ |
| C、1698kJ |
| D、2063 kJ |
下列关于能量转换的认识中,不正确的是( )
| A、电解水生成氢气和氧气时,电能转化为化学能 |
| B、绿色植物进行光合作用时,太阳能转化为化学能 |
| C、每个化学反应都伴随着能量的变化 |
| D、当反应物浓度等于生成物浓度时,可逆反应一定已达到化学平衡状态 |
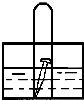 如图,水槽中试管内有一枚铁钉,放置数天观察,铁钉有明显生锈的迹象:
如图,水槽中试管内有一枚铁钉,放置数天观察,铁钉有明显生锈的迹象: