题目内容
下列有关原电池的说法正确的是( )
| A、失去电子的极是正极 |
| B、正极发生氧化反应 |
| C、电子从正极流向负极 |
| D、发生氧化反应的是负极 |
考点:原电池和电解池的工作原理
专题:
分析:原电池是把化学能转变为电能的装置,原电池放电时,负极上失去电子发生氧化反应,即电子流出的是负极,正极上得电子发生还原反应,电子从负极流向正极,以此解答.
解答:
解:A、负极上失去电子发生氧化反应,故A错误;
B、正极上得电子发生还原反应,故B错误;
C、电子从负极流向正极,故C错误;
D、负极上失去电子发生氧化反应,故D正确;
故选D.
B、正极上得电子发生还原反应,故B错误;
C、电子从负极流向正极,故C错误;
D、负极上失去电子发生氧化反应,故D正确;
故选D.
点评:本题考查了原电池原理,难度不大,会判断电子在外电路的流向及正负极发生的反应类型即可.

练习册系列答案
相关题目
下列溶液中含3种分子的是( )
| A、氯水 | B、溴的四氯化碳溶液 |
| C、醋酸溶液 | D、酒精水溶液 |
下列物质的水溶液能够导电,但属于非电解质的是( )
| A、H2S |
| B、碳酸氢钠 |
| C、氨气 |
| D、氢氧化钾 |
下列解释事实的化学用语不正确的是( )
| A、生活中用纯碱做洗涤剂的原理:CO32-+H2O?HCO3-+OH- |
| B、已知某温度和压强下,将0.5molN2和1.5mol H2置于密闭容器中充分反应生成NH3(g)放热19.3KJ,故有:N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ?mol-1 |
| C、“NO2球”浸泡在冷水中,颜色变浅:2NO2(g)?N2O4(g)△H<0 |
| D、NaHSO3溶液呈酸性:HSO3-+H2O?SO32-+H3O+ |
在一定温度下,CO和CH4燃烧的热化学方程式分别为:2CO(g)+O2(g)═2CO2(g)△H=-566kJ/mol
CH4(g)+O2(g)═
CO2(g)+H2O(l)△H=-445kJ/mol,1molCO和2mol CH4组成的混合气体,在相同条件下完全燃烧时,释放的热量为( )
| 1 |
| 2 |
| 1 |
| 2 |
| A、2346 kJ |
| B、2670 kJ |
| C、1698kJ |
| D、2063 kJ |
某反应过程能量变化如图所示,下列说法正确的是( )
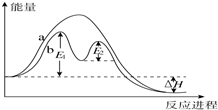

| A、反应过程a有催化剂参与 |
| B、该反应为放热反应,热效应不等于△H |
| C、使用催化剂,可改变该反应的活化能 |
| D、有催化剂条件下,反应的活化能等于E1-E2 |
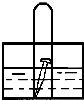 如图,水槽中试管内有一枚铁钉,放置数天观察,铁钉有明显生锈的迹象:
如图,水槽中试管内有一枚铁钉,放置数天观察,铁钉有明显生锈的迹象: