题目内容
8.A、B、C、D、E、F、G七种短周期元素,原子序数依次增大.由A、B形成的单质在一定条件下可生成气体X且X的水溶液呈碱性;D原子K层电子数是其M层电子数的2倍;E的简单阳离子与X具有相同电子数,且E的简单阳离子是同周期中简单离子半径最小的元素;F元素的原子最外层比次外层少两个电子,C和G的最外层电子数之和为13.则(1)C在周期表中的位置为第二周期第VIIA族;
(2)写出:D在C单质中燃烧所生成淡黄色的固体的电子式
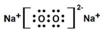
(3)A、B、D、E四种元素的原子半径由大到小的顺序为Na>Al>N>H.(用元素符号表示 )
(4)G的单质在反应中常作氧化剂,该单质的水溶液与F的低价氧化物反应的化学方程式为SO2+Cl2+2H2O═H2SO4+2HCl.
(5)写出由A、C、D、F这四种元素共同组成的2种化合物在水溶液中发生反应的离子方程式:H++HSO3-=SO2↑+2H2O.
分析 A、B、C、D、E、F、G七种短周期元素,原子序数依次增大,由A、B形成的单质在一定条件下可生成气体X且X的水溶液呈碱性,则X为NH3,则A为H、B为N;D原子K层电子数是其M层电子数的2倍,K层含有1个电子,则D的原子序数为11,为Na元素;E的简单阳离子与X具有相同电子数,且E的简单阳离子是同周期中简单离子半径最小的元素,氨气分子中含有10个电子,则E位于第三周期,第三周期中简单离子半径最小的元素为Al;F元素的原子最外层比次外层少两个电子,则F最外层含有6个电子,为S元素;G的原子序数大于S,且为短周期元素,则G为Cl元素;C和G的最外层电子数之和为13,则C最外层含有电子数=13-7=6,结合原子序数可知C为O元素,据此进行解答.
解答 解:A、B、C、D、E、F、G七种短周期元素,原子序数依次增大,由A、B形成的单质在一定条件下可生成气体X且X的水溶液呈碱性,则X为NH3,则A为H、B为N;D原子K层电子数是其M层电子数的2倍,K层含有1个电子,则D的原子序数为11,为Na元素;E的简单阳离子与X具有相同电子数,且E的简单阳离子是同周期中简单离子半径最小的元素,氨气分子中含有10个电子,则E位于第三周期,第三周期中简单离子半径最小的元素为Al;F元素的原子最外层比次外层少两个电子,则F最外层含有6个电子,为S元素;G的原子序数大于S,且为短周期元素,则G为Cl元素;C和G的最外层电子数之和为13,则C最外层含有电子数=13-7=6,结合原子序数可知C为O元素,
(1)根据分析可知,C为O元素,原子序数为8,位于周期表中第二周期 第VIIA族,
故答案为:第二周期 第VIIA族;
(2)D(Na)在C单质(O2)中燃烧所生成的淡黄色固体为过氧化钠,过氧化钠为离子化合物,其电子式为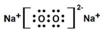 ,
,
故答案为: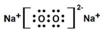 ;
;
(3)A、B、D、E分别为H、N、Na、Al,原子的电子层越多,离子半径越小,电子层相同时核电荷数越大,原子半径越小,则四种元素的原子半径由大到小的顺序为:Na>Al>N>H,
故答案为:Na>Al>N>H;
(4)G的单质(Cl2)在反应中常作氧化剂,该单质的水溶液与F的低价氧化物(SO2)发生氧化还原反应,反应的化学方程式为:SO2+Cl2+2H2O═H2SO4+2HCl,
故答案为:SO2+Cl2+2H2O═H2SO4+2HCl;
(5)A、C、D、F分别为H、O、Na、S元素,这四种元素共同组成的2种化合物在水溶液中发生反应,满足条件的化合物为NaHSO4和NaHSO3,反应的离子方程式为:
H++HSO3-=SO2↑+2H2O,
故答案为:H++HSO3-=SO2↑+2H2O.
点评 本题考查位置、结构与性质关系的应用,题目难度中等,涉及电子式、化学方程式、离子方程式、原子半径大小比较等知识,推断元素为解答关键,注意掌握原子结构与元素周期律之间的关系.

| A. | 普通玻璃 | B. | 空气 | C. | 漂白粉 | D. | 干冰 |
 的说法中不正确的是( )
的说法中不正确的是( )| A. | 最多只有5个碳原子在同一直线上 | B. | 最多有11个碳原子在同一平面上 | ||
| C. | 有7个碳原子可能在同一直线上 | D. | 最多有19个原子在同一平面上 |
| A. | 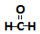 + +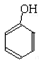 → →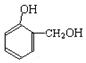 属于取代反应 属于取代反应 | |
| B. | 可以用酸性高锰酸钾溶液鉴别苯和己烷 | |
| C. | 有机物C3H8和C6H14一定是同系物 | |
| D. | 丙烯分子中可能有8个原子处于同一平面 |
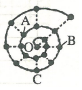 小明在研究元素时发现,可以将前18号元素排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )
小明在研究元素时发现,可以将前18号元素排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )| A. | 虚线相连的元素处于同一族,A元素位于元素周期表ⅥA族 | |
| B. | 离O点越远的元素原子半径一定越大 | |
| C. | B、C最高价氧化物的水化物可以相互反应 | |
| D. | B元素是图中金属性最强的元素 |

| A. | 在加热和催化剂作用下,最多能与4 mol H2反应 | |
| B. | 能使溴水褪色 | |
| C. | 不能使KMnO4酸性溶液褪色 | |
| D. | 一定条件下,能发生取代反应 |
 B.
B. C.
C. D.
D.
 废旧印刷电路板的回收利用可实现资源再生,并减少污染.废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末.
废旧印刷电路板的回收利用可实现资源再生,并减少污染.废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末.