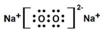题目内容
6. 废旧印刷电路板的回收利用可实现资源再生,并减少污染.废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末.
废旧印刷电路板的回收利用可实现资源再生,并减少污染.废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末.(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是BD
A.热裂解形成燃油 B.露天焚烧
C.作为有机复合建筑材料的原料 D.直接填埋
(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g)△H=+64.39kJ.mol+1
2H2O2(aq)=2H2O(1)+O2(g)△H=-196.46kJ.mol-1
H2(g)+$\frac{1}{2}$O2(g)=2H2O(l)△H=-285.84kj.mol-1
在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l)△H=-319.6KJ/mol.
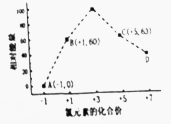
(3)一定条件,在水溶液中1molC1+、C1Ox-(X=1,2,3,4)的能量(kj)相对大小如图所示.
①相对能量最高的C1Ox-名称为氯酸根离子
②B→A+C反应的热化学方程式为3ClO-═ClO3-+2Cl-.
分析 (1)热裂解形成燃油及作为有机复合建筑材料的原料都可实现资源的再利用;露天焚烧能生成有害气体则污染空气,直接填埋则废旧印刷电路板中的重金属离子会污染土壤,据此分析解答;
(2)①Cu(s)+2H+(aq)=Cu2+(aq)+H2(g)△H=+64.39kJ/mol
②2H2O2(l)=2H2O(l)+O2(g)△H=-196.46kJ/mol
③H2(g)+1/2O2(g)=H2O(l)△H=-285.84kJ/mol
依据盖斯定律①+$\frac{1}{2}$②+③得到:Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l);
(3)①据图示分析相对能量最高时x为+3价;
②B→A+C发生反应:3 ClO-=ClO3-+2Cl-,反应热△H=生成物总能量-反应物总能量,注意离子为溶液状态,进而书写热化学方程式;
解答 解:(1)因热裂解形成燃油及作为有机复合建筑材料的原料都可实现资源的再利用,露天焚烧能生成有害气体则污染空气,直接填埋则废旧印刷电路板中的重金属离子会污染土壤,所以符合环境保护理念的是BD;
故答案为:BD;
(2)①Cu(s)+2H+(aq)=Cu2+(aq)+H2(g)△H=+64.39kJ/mol
②2H2O2(l)=2H2O(l)+O2(g)△H=-196.46kJ/mol
③H2(g)+1/2O2(g)=H2O(l)△H=-285.84kJ/mol
依据盖斯定律①+$\frac{1}{2}$②+③得到:Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l)△H=-319.6KJ/mol;
故答案为:Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l)△H=-319.6KJ/mol;
(3)①据图示分析相对能量最高时x为+3价,故为C1O3-名称为氯酸根离子,
故答案为:氯酸根离子;
②B→A+C发生反应:3 ClO-=ClO3-+2Cl-,根据离子能量可知,反应热△H=53kJ/mol+2×0kJ/mol-3×60kJ/mol=-117kJ/mol,故反应热化学方程式为:3 ClO-(aq)═ClO3-(aq)+2Cl-(aq)△H=-117kJ/mol,
故答案为:3ClO-═ClO3-+2Cl-.
点评 本题考查了热化学方程式的计算书写,盖斯定律的计算应用以及热化学方程式意义的计算等知识,题目较简单.

 名校课堂系列答案
名校课堂系列答案 ,该烯烃可能的结构有( )
,该烯烃可能的结构有( )| A. | 1 种 | B. | 2 种 | C. | 3 种 | D. | 4 种 |
| 选项 | ① | ② | ③ | 实验结论 |  |
| A | 浓盐酸 | MnO2 | NaBr溶液 | 氧化性Cl2>Br2 | |
| B | 浓氨水 | 碱石灰 | Al2(SO4)3溶液 | Al(OH)3具有两性 | |
| C | 浓硫酸 | Na2SO3 | FeCl3溶液 | SO2具有还原性 | |
| D | 稀盐酸 | Na2C03 | Na2Si03 | 非金属性:C>Si |
| A. | A | B. | B | C. | C | D. | D |
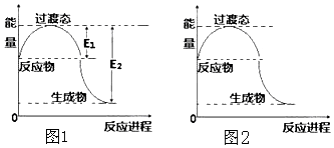 回答下列问题:
回答下列问题:(1)2molCH4(g)和4mol O2(g)反应生成CO2(g)和H2O(g)过程中的能量变化如图1所示.已知E1=134KJ,E2=368KJ.则热化学方程式为2CH4(g)+4O2(g)=2CO2(g)+4H2O(g)△H=-234 kJ•mol-1生成18g H2O(l)放出或吸收的能量(范围)>58.5KJ
请在图2中画出加入催化剂后,反应过程中的能量变化曲线.
(2)在一定条件下,已知下列反应的热化学反应式:
C(石墨,s)+O2(g)=CO2(g)△H1; 2H2(g)+O2(g)=2H2O(l)△H2
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H3
由C(石墨,s)和气态H2反应合成气态1mol C2H2的热化学方程式2C (s,石墨)+H2(g)=C2H2(g))△H=2△H1+$\frac{1}{2}$△H2-$\frac{1}{2}$△H3;
(3)工业上可通过CO(C≡O)和H2化合制得CH3OH(气态),各键能数据如表所示
| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能(kJ/mol) | 348 | 413 | 436 | 358 | 1072 | 463 |
| A. | 当CaCO3的浓度不再变化时,表明达到平衡状态 | |
| B. | 重新达到新平衡时,CO2的压强为P | |
| C. | 扩大容器体积,重新达到平衡时n(CO2)增多 | |
| D. | 常温常压下CaCO3的分解反应不一定自发 |
| A. | Na+物质的量为0.2mol | B. | Na+物质的量浓度为0.2 mol•L-1 | ||
| C. | SO42-物质的量为0.1mol | D. | SO42-物质的量浓度为0.2 mol•L-1 |