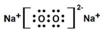题目内容
13.甲、乙、丙、丁、戊代表五种元素.请填空:(1)甲元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素名称为氮,其基态原子的电子排布式为1s22s22p3.
(2)乙元素的负一价离子和丙元素的正一价离子的电子层结构都与氩相同,乙的元素符号为Cl,丙元素的基态原子的电子排布式为1s22s22p63s23p64s1.
(3)丁元素的正三价离子的3d能级为半充满,丁的元素符号为Fe,其基态原子的电子排布式为1s22s22p63s23p63d64s2.
(4)戊元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,该元素在周期表中的位置是第四周期第ⅠB族(指明周期与族),其基态原子价层电子排布式为3d104s1.
分析 (1)甲元素基态原子的最外层有3个未成对电子,次外层有2个电子,原子核外电子排布为1s22s22p3;
(2)乙元素的负一价离子和丙元素的正一价离子的电子层结构都与氩相同,则乙为Cl元素、丙为K元素;
(3)丁元素的正三价离子的3d能级为半充满,原子核外电子排布式为1s22s22p63s23p63d64s2;
(4)戊元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,原子核外电子排布为1s22s22p63s23p63d104s1.
解答 解:(1)甲元素基态原子的最外层有3个未成对电子,次外层有2个电子,故为N元素,元素名称为氮;故原子核外电子排布为1s22s22p3,
故答案为:氮;1s22s22p3;
(2)乙元素的负一价离子和丙元素的正一价离子的电子层结构都与氩相同,则乙为Cl元素;丙为K元素,故原子核外电子排布为1s22s22p63s23p64s1,
故答案为:Cl;1s22s22p63s23p64s1;
(3)丁元素的正三价离子的3d能级为半充满,原子核外电子排布式为1s22s22p63s23p63d64s2;为Fe元素,
故答案为:Fe;1s22s22p63s23p63d64s2;
(4)戊元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,原子核外电子排布为1s22s22p63s23p63d104s1,元素在周期表中位置为:第四周期第ⅠB族,
故答案为:第四周期第ⅠB族;3d104s1.
点评 本题考查结构性质位置关系应用,侧重对核外电子排布规律的考查,难度不大,注意对基础知识的理解掌握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.下列化合物分子中的所有原子都处于同一平面的是( )
| A. | 溴苯 | B. | 乙醛 | C. | 四氯化碳 | D. | 丙烯 |
1.下列化学用语正确的是( )
| A. | 苯的最简式:C6H6 | B. | 乙醇的分子式:CH3CH2OH | ||
| C. | 乙烯的结构简式:CH2CH2 | D. | 2-乙基-1,3-丁二烯分子的键线式: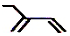 |
18.下列有关实验操作、现象和解释或结论都正确的是( )
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 向溶液X中先滴加稀硝酸,再滴加Ba(NO3)2溶液 | 出现白色沉淀 | 溶液X中一定含有SO42- |
| B | 向稀硝酸中加入少量铁粉 | 有气泡产生 | 说明Fe置换出硝酸中的氢,生成了氢气 |
| C | 向一定浓度的Na2SiO3溶液中通入适量CO2气体 | 出现白色胶状物质 | H2CO3的酸性比H2SiO3的酸性强 |
| D | 向饱和Na2CO3溶液中通入足量CO2 | 溶液变浑浊 | NaHCO3为难溶物 |
| A. | A | B. | B | C. | C | D. | D |
5.利用如图所示装置进行下列实验,能得出相应实验结论的是( )
| 选项 | ① | ② | ③ | 实验结论 | 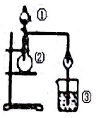 |
| A | 浓盐酸 | MnO2 | NaBr溶液 | 氧化性Cl2>Br2 | |
| B | 浓氨水 | 碱石灰 | Al2(SO4)3溶液 | Al(OH)3具有两性 | |
| C | 浓硫酸 | Na2SO3 | FeCl3溶液 | SO2具有还原性 | |
| D | 稀盐酸 | Na2C03 | Na2Si03 | 非金属性:C>Si |
| A. | A | B. | B | C. | C | D. | D |
11. 回答下列问题:
回答下列问题:
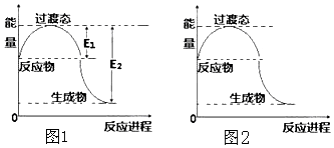
(1)2molCH4(g)和4mol O2(g)反应生成CO2(g)和H2O(g)过程中的能量变化如图1所示.已知E1=134KJ,E2=368KJ.则热化学方程式为2CH4(g)+4O2(g)=2CO2(g)+4H2O(g)△H=-234 kJ•mol-1生成18g H2O(l)放出或吸收的能量(范围)>58.5KJ
请在图2中画出加入催化剂后,反应过程中的能量变化曲线.
(2)在一定条件下,已知下列反应的热化学反应式:
C(石墨,s)+O2(g)=CO2(g)△H1; 2H2(g)+O2(g)=2H2O(l)△H2
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H3
由C(石墨,s)和气态H2反应合成气态1mol C2H2的热化学方程式2C (s,石墨)+H2(g)=C2H2(g))△H=2△H1+$\frac{1}{2}$△H2-$\frac{1}{2}$△H3;
(3)工业上可通过CO(C≡O)和H2化合制得CH3OH(气态),各键能数据如表所示
写出合成1mol CH3OH(气态)的热化学方程式CO(g)+2H2(g)?CH3OH (g)△H=-116 kJ•mol-1.
 回答下列问题:
回答下列问题:(1)2molCH4(g)和4mol O2(g)反应生成CO2(g)和H2O(g)过程中的能量变化如图1所示.已知E1=134KJ,E2=368KJ.则热化学方程式为2CH4(g)+4O2(g)=2CO2(g)+4H2O(g)△H=-234 kJ•mol-1生成18g H2O(l)放出或吸收的能量(范围)>58.5KJ
请在图2中画出加入催化剂后,反应过程中的能量变化曲线.
(2)在一定条件下,已知下列反应的热化学反应式:
C(石墨,s)+O2(g)=CO2(g)△H1; 2H2(g)+O2(g)=2H2O(l)△H2
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H3
由C(石墨,s)和气态H2反应合成气态1mol C2H2的热化学方程式2C (s,石墨)+H2(g)=C2H2(g))△H=2△H1+$\frac{1}{2}$△H2-$\frac{1}{2}$△H3;
(3)工业上可通过CO(C≡O)和H2化合制得CH3OH(气态),各键能数据如表所示
| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能(kJ/mol) | 348 | 413 | 436 | 358 | 1072 | 463 |
12.某有机物Z具有较广泛的抗菌作用,其生成机理可由X与Y相互作用:
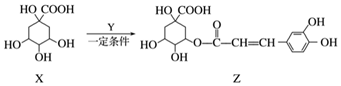
下列有关叙述中不正确的是( )

下列有关叙述中不正确的是( )
| A. | Z结构中有1个手性碳原子 | |
| B. | Y的分子式为C9H8O4 | |
| C. | 1 mol Z与足量NaOH溶液反应,最多消耗8 mol NaOH | |
| D. | Z与浓溴水既能发生取代反应又能发生加成反应 |