题目内容
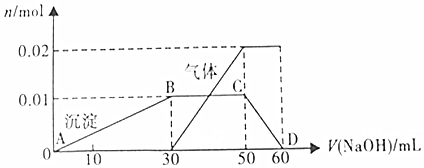
15.在Cu-Zn原电池中,计算当有6.4g铜生成时,锌的质量变化了多少克?电路中转移了多少mol的电子?当加入的CuSO4溶液的体积为200ml,则,参与反应的物质的量浓度为多少?分析 根据电池反应式为Cu2++Zn=Zn2++Cu中铜的质量,求参加反应锌的质量;并据Cu2++Zn=Zn2++Cu~转移电子2mol,当中铜的质量,求转移的电子数目;据c=$\frac{n}{V}$,求参与反应的CuSO4物质的量浓度,据此进行分析.
解答 解:电池反应式为:Cu2++Zn=Zn2++Cu,设参加反应锌的质量为x
Cu2++Zn=Zn2++Cu
65g 64g
x 6.4g
则:x=6.5g,
设转移电子的物质的量为y,
Cu2++Zn=Zn2++Cu~转移电子2mol
64g 2mol
6.4g y
则:y=0.2mol,
根据铜原子守恒得n(Cu)=n(CuSO4)=$\frac{6.4g}{64g/mol}$=0.1mol,
所以C(CuSO4)=$\frac{0.1mol}{0.2L}$=0.5mol/L.
答:锌的质量变化了6.5克,电路中转移了0.2mol的电子,参与反应的物质的量浓度为0.5mol/L.
点评 本题以电解原理为载体考查了根据物质的量的计算,根据各个物理量之间的关系式来分析解答,注意结合守恒思想分析,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.已知CH3COOH与CH3COONa两种溶质1:1的混合稀溶液呈酸性.该溶液中三种微粒浓度排序正确的是( )
| A. | c(CH3COO-)>c(Na+)>c(CH3COOH) | B. | c(CH3COOH)>c(Na+)>c(CH3COO-) | ||
| C. | c(Na+)>c(CH3COO-)>c(CH3COOH) | D. | c(CH3COO-)>c(CH3COOH)>c(Na+) |
3.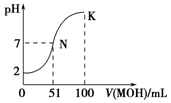 常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中正确的是( )
常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中正确的是( )
 常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中正确的是( )
常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中正确的是( )| A. | MOH为一元强碱 | |
| B. | K点对应的溶液中:c(M+)+c(MOH)=c(A-) | |
| C. | K点对应的溶液中:c(MOH)+c(OH-)-c (H+)=0.005 mol•L-1 | |
| D. | N点水的电离程度小于K点水的电离程度 |
10.在25℃时,H2R及其钠盐的溶液中,H2R、HR-、R2-分别在三者中所占的物质的量分数(α)随溶液pH变化关系如图所示,下列叙述错误的是( )


| A. | H2R是二元弱酸,其Ka1=1×10-2 | |
| B. | NaHR在溶液中水解程度小于电离程度 | |
| C. | pH<7.2的溶液中一定存在:c( Na+)>c( HR-)>c(R2-)>c(H+)>c(OH-) | |
| D. | 含Na2R与NaHR各0.1 mol的混合溶液的pH=7.2 |
20.根据实际及反应本质判断,下列化学反应中能设计成原电池的是( )
| A. | 2FeCl3+Cu═2FeCl2+CuCl2 | B. | 2K+2H2O═2KOH+H2↑ | ||
| C. | NaOH+HCl═NaCl+H2O | D. | C(s)+H2O(g)═CO(g)+H2(g) |
3.下列说法正确的是( )
| A. | 已知2C(s)+O2(g)═2CO(g)△H=-221 kJ•mol-1,则C(碳)的燃烧热为-110.5 kJ•mol-1 | |
| B. | 在101KPa下氢气的燃烧热△H=-285.5 kJ•mol-1,则水分解的热化学方程式为:2H2O(l)=2H2(g)+O2(g)△H=+285.5 kJ•mol-1 | |
| C. | 已知中和热△H=-57.3 kJ•mol-1,若将含0.5 mol H2SO4的稀溶液与含1 mol NaOH的稀溶液混合,放出的热量为57.3 kJ | |
| D. | 含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出热量28.7 kJ,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)═CH3COONa(aq)+H2O(l)△H=-57.4 kJ•mol-1 |
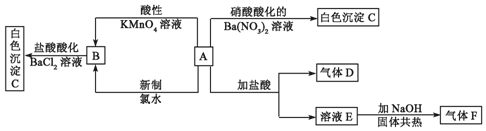
 ;F的结构式
;F的结构式 ;
;