题目内容
1.在合成氨反应中,由a mol N2和b mol H2混合反应达到平衡时,有c mol NH3生成,则NH3在反应混合物中所占的体积分数是( )| A. | $\frac{100c}{a+b}$% | B. | $\frac{a}{a+b+c}$×100% | C. | $\frac{100c}{a+b-c}$% | D. | $\frac{100c}{a+b-\frac{c}{2}}$% |
分析 N2(g)+3H2(g) 2NH3 (g)
2NH3 (g)
起始(mol) a b 0
反应(mol) x 3x 2x
平衡(mol) a-x b-3x 2x
达平衡,测得NH3为3mol,则2x=3,则x=1.5mol,以此计算.
解答 解:设转化的氮气为xmol,则
N2(g)+3H2(g) 2NH3 (g)
2NH3 (g)
起始(mol) a b 0
反应(mol) x 3x 2x
平衡(mol) a-x b-3x 2x
达平衡,测得NH3为3mol,则2x=c,则x=$\frac{c}{2}$mol,氨气的体积分数等于物质的量分数,所以$\frac{2x}{a-x+b-3x+2x}$×100%=$\frac{2x}{a+b-2x}$×100%=
$\frac{c}{a+b-c}$×100%=$\frac{100c}{a+b-c}$%.
故选:C.
点评 本题考查化学平衡的计算,明确化学平衡三段法计算方法是解答本题的关键,注意体积分数及转化率的计算,题目难度中等.

练习册系列答案
相关题目
17.下列说法正确的是( )


| A. | 分子式为C2H4O2的有机化合物性质相同 | |
| B. | 由如图可得H2O2分解的热化学方程式为2H2O2(aq)═2H2O(l)+O2(g),△H=(E1-E2)kJ•mol-1 | |
| C. | Al2O3具有很高的熔点,可用于制造熔融烧碱的坩埚 | |
| D. | Na2O2与CO2反应产生1 mol O2理论上转移的电子数约为26.02×1023 |
18.以下化学用语正确的是( )
| A. | 乙醇的分子式:CH3CH2OH | B. | CH3COCH3的官能团名称:醚键 | ||
| C. |  的名称为:2,6-二甲基-3-乙基庚烷 的名称为:2,6-二甲基-3-乙基庚烷 | D. |  的类别:醇类 的类别:醇类 |
15.下列实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 向盛有二氧化锰的锥形瓶中滴入浓盐酸 | 产生黄绿色气体 | 氧化性:MnO2>Cl2 |
| B | 分别向水和乙醇中投入等质量、等大小的金属钠 | 水中产生气泡较快 | 羟基中氢的活泼性:H2O>乙醇 |
| C | 向滴有KSCN试剂的Fe(NO3)2的溶液中加入盐酸 | 溶液变红 | Fe2+被盐酸氧化为Fe3+ |
| D | 向饱和石灰水中加入Na2O2 | 有白色沉淀析出 | Na2O2与Ca(OH)2反应生成白色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
13.硒是人体必须的微量元素,下列关于${\;}_{34}^{78}$Se与${\;}_{34}^{80}$Se的说法正确的是( )
| A. | ${\;}_{34}^{78}$Se与${\;}_{34}^{80}$Se都含有34个中子 | |
| B. | ${\;}_{34}^{78}$Se与${\;}_{34}^{80}$Se分别含有44和46个质子 | |
| C. | ${\;}_{34}^{78}$Se与${\;}_{34}^{80}$Se因含有相同的质子数故互为同位素 | |
| D. | ${\;}_{34}^{78}$Se与${\;}_{34}^{80}$Se含有相同的电子数,因此性质一样 |
10.下列实验操作中有错误的是( )
| A. | 用蒸馏水润湿的试纸测某溶液的pH,一定会使结果偏低 | |
| B. | 蒸馏操作时,冷却水应从冷凝管的下口通入,上口流出 | |
| C. | 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 | |
| D. | 蒸发操作时,当有较多晶体析出时,停止加热 |
11.下列说法不正确的是( )
| A. | 硅酸盐工业使用的每一种原料中都含有硅元素 | |
| B. | 水泥.普通玻璃都是混合物 | |
| C. | 生产水泥和玻璃都需用石灰石 | |
| D. | 用纯净的石英可制成石英玻璃,它的膨胀系数小,常用来制造耐高温的化学仪器 |
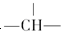 ,则该结构的烃的一氯取代物最多可能有几种(不考虑立体异构)( )
,则该结构的烃的一氯取代物最多可能有几种(不考虑立体异构)( )