题目内容
(1)密度为0.365g/mL、质量分数为20%的盐酸的物质的量浓度为 mol/L.
(2)取此盐酸500mL和足量的镁反应后,求:
①放出的H2在标准状况下的体积.
②将生成的H2缓慢通过过量的灼热CuO,求理论上被还原出的铜的质量.
(2)取此盐酸500mL和足量的镁反应后,求:
①放出的H2在标准状况下的体积.
②将生成的H2缓慢通过过量的灼热CuO,求理论上被还原出的铜的质量.
考点:化学方程式的有关计算
专题:
分析:(1)结合c=
计算;
(2)①结合Mg+2HCl=MgCl2+H2↑计算;
②结合H2+CuO
Cu+H2O计算.
| 1000ρw |
| M |
(2)①结合Mg+2HCl=MgCl2+H2↑计算;
②结合H2+CuO
| ||
解答:
解:(1)密度为0.365g/mL、质量分数为20%的盐酸的物质的量浓度为c=
=
=2mol/L,故答案为:2;
(2)①n(HCl)=0.5L×2mol/L=1mol,由Mg+2HCl=MgCl2+H2↑可知,生成氢气为1mol×
=0.5mol,其标况下体积为0.5mol×22.4L/mol=11.2L,
答:放出的H2在标准状况下的体积为11.2L;
②由H2+CuO
Cu+H2O可知,氢气与Cu的物质的量相同,则理论上被还原出的铜的质量为0.5mol×64g/mol=32g,
答:理论上被还原出的铜的质量为32g.
| 1000ρw |
| M |
| 1000×0.365×20% |
| 36.5 |
(2)①n(HCl)=0.5L×2mol/L=1mol,由Mg+2HCl=MgCl2+H2↑可知,生成氢气为1mol×
| 1 |
| 2 |
答:放出的H2在标准状况下的体积为11.2L;
②由H2+CuO
| ||
答:理论上被还原出的铜的质量为32g.
点评:本题考查化学反应方程式的计算,为高频考点,把握发生的反应及反应中的物质的量关系为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 全优测试卷系列答案
全优测试卷系列答案 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案
相关题目
下列有关实验的操作和现象描述的对应关系正确的是( )
| A、将NaOH溶液逐滴滴入FeSO4溶液中,只观察到白色沉淀 |
| B、将钠放入水中,钠浮在水面上、熔成一个闪亮的小球、四处游动、溶液变红 |
| C、除去表面保护膜的铝在酒精灯上加热到熔化,熔化的铝以小液滴的形式滴落下来 |
| D、在滴有酚酞溶液的 Na2SiO3溶液中,逐滴加入稀盐酸,溶液的红色逐渐变浅,并有白色胶状物生成 |
下列做法正确的是( )
| A、金属钠着火时,用大量水进行灭火 |
| B、铝制餐具可代替铁制餐具长时间存放酸性、碱性食物 |
| C、在50mL量筒中配制0.1mol?L-1碳酸钠溶液 |
| D、易燃、易爆药品与有强氧化性的物质要分开放置并远离火源 |
要提取碘水中的碘单质,所选萃取试剂及说法正确的是( )
| A、用酒精后静置则上层颜色加深 |
| B、用汽油二者混溶不分层 |
| C、用CCl4后静置则上层颜色变浅,下层颜色加深 |
| D、用汽油后静置则上层颜色变浅,下层颜色加深 |
下列说法正确的是:( )
| A、1mol蔗糖可水解生成2mol葡萄糖 |
| B、CH3-CH=CH-CH3与C3H6一定互为同系物 |
C、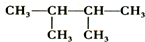 的名称是2,3-甲基丁烷 的名称是2,3-甲基丁烷 |
| D、乙醇可与水以任意比例混溶,是因为相似相溶原理且与水形成了氢键 |
设NA为阿伏加德罗常数的值,下列叙述中正确的是( )
| A、标准状况下,11.2L乙醇含有的分子数为0.5NA |
| B、常温常压下,22 g CO2含有的原子数为1.5NA |
| C、12 g 金属镁变成镁离子时失去的电子数为0.5NA |
| D、0.1mol?L-1Na2SO4溶液中含有的钠离子数为0.2NA |
在醋酸中存在电离平衡:CH3COOH?CH3COO-+H+,要使溶液中的c(CH3COO-)提高,应采取的措施是( )
| A、加水 |
| B、加热 |
| C、加CH3COONa固体 |
| D、加很稀的NaOH溶液 |
