题目内容
1.短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Z为地壳中含量最高的金属元素.下列说法正确的是( )| X | ||||||
| Y | Z | W |
| A. | 工业上电解YW饱和溶液冶炼金属Y | |
| B. | 气态氢化物的稳定性:W>X | |
| C. | Y、W的最高价氧化物的水化物均能溶解金属Z | |
| D. | 简单离子半径的大小顺序:r(Y+)>r(X-) |
分析 Z为地壳中含量最高的金属元素,则Z为Al,由元素在周期表中位置可知:Y为Na,X为F,W为Cl.
A.工业上电解熔融氯化钠冶炼金属钠;
B.非金属性越强,氢化物越稳定;
C.Al能与强酸、强碱反应而溶解;
D.电子层结构相同核电荷数越大,离子半径越小,电子层越多离子半径越大.
解答 解:Z为地壳中含量最高的金属元素,则Z为Al,由元素在周期表中位置可知:Y为Na,X为F,W为Cl.
A.电解饱和氯化钠溶液得到氢氧化钠、氢气与氯气,是氯碱工业基础,而工业上电解熔融氯化钠冶炼金属钠,故A错误;
B.同主族自上而下非金属性减弱,非金属性越强,氢化物越稳定,故氢化物稳定性X>W,故B错误;
C.Al能与氢氧化钠、高氯酸反应而溶解,故C正确;
D.Na+、F-离子电子层结构相同核电荷数越大,离子半径越小,故离子半径r(Na+)<r(F-),故D错误;
故选C.
点评 本题考查元素周期表与元素周期律,为高频考点,侧重于学生的分析能力的考查,难度不大,明确元素是解题关键,注意对元素周期表的掌握.

练习册系列答案
 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案
相关题目
11.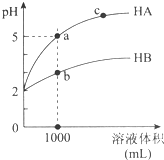 室温下,pH均为2的两种一元酸HA和HB各1mL,分别加水稀释,pH随溶液体积的变化曲线如图所示.下列说法正确的是( )
室温下,pH均为2的两种一元酸HA和HB各1mL,分别加水稀释,pH随溶液体积的变化曲线如图所示.下列说法正确的是( )
 室温下,pH均为2的两种一元酸HA和HB各1mL,分别加水稀释,pH随溶液体积的变化曲线如图所示.下列说法正确的是( )
室温下,pH均为2的两种一元酸HA和HB各1mL,分别加水稀释,pH随溶液体积的变化曲线如图所示.下列说法正确的是( )| A. | HA的酸性比HB的酸性弱 | |
| B. | a点溶液的导电性比c点溶液的导电性弱 | |
| C. | 若两溶液无限稀释,则它们的c(H+)相等 | |
| D. | 对a、b两点溶液同时升高温度,则$\frac{c({A}^{-})}{{c(B}^{-})}$增大 |
9.对Na、Mg、Al的有关性质的叙述正确的是( )
| A. | 离子半径:Na+>Mg2+>Al3+ | B. | 原子半径:Na<Mg<Al | ||
| C. | 离子的氧化性:Na+>Mg2+>Al3+ | D. | 单质的还原性:Na<Mg<Al |
6.下列离子方程式正确的是( )
| A. | FeCl3溶液中加入过量的氨水:Fe3++3OH-→Fe(OH)3↓ | |
| B. | AlCl3溶液中加入过量的氨水:Al3++4OH-→AlO2-+2H2O | |
| C. | 金属铁与过量的稀盐酸反应:2Fe+6H+→2Fe3++3H2↑ | |
| D. | 氧化铝与氢氧化钠溶液反应:Al2O3+2OH-→2AlO2-+H2O |
13.我国报道的高温超导体中,铊是组成成分之一.已知铊和铝是同族元素,关于铊的判断错误的是( )
| A. | 铊是银白色的金属 | B. | 能置换出盐酸中氢离子 | ||
| C. | 能生成+3价的化合物 | D. | 氢氧化铊是两性氢氧化物 |
10.下列离子方程式书写正确的是( )
| A. | 金属铁与稀硝酸反应:Fe+2H+→Fe2++H2↑ | |
| B. | 金属铝与烧碱溶液的反应:Al+2OH-→AlO2-+H2↑ | |
| C. | AlCl3溶液中加入过量氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ | |
| D. | 偏铝酸钠溶液中加过量盐酸:AlO2-+4H+=Al3++2H2O |
11.下列分析中正确的是( )
| A. | 烷烃在任何情况下均不与强酸、强碱、氧化剂反应 | |
| B. | 正丁烷分子中四个碳原子可能在同一直线上 | |
| C. | 常温常压下 是气态 是气态 | |
| D. | 含有碳元素的化合物不一定是烃 |