题目内容
9.对Na、Mg、Al的有关性质的叙述正确的是( )| A. | 离子半径:Na+>Mg2+>Al3+ | B. | 原子半径:Na<Mg<Al | ||
| C. | 离子的氧化性:Na+>Mg2+>Al3+ | D. | 单质的还原性:Na<Mg<Al |
分析 Na、Mg、Al位于第三周期,原子序数逐渐增大,原子半径逐渐减小,金属性逐渐减弱,单质的还原性逐渐减弱;单质还原性越强,阳离子的氧化性越弱,则阳离子的氧化性逐渐增强;离子的电子层相同时,核电荷数越大,离子半径越小,据此进行解答.
解答 解:A.Na+、Mg2+、Al3+的电子层数相同,核电荷数逐渐增大,则离子半径逐渐减小,所以离子半径大小为:Na+>Mg2+>Al3+,故A正确;
B.同一周期中,核电荷数越大,原子半径越小,则原子半径大小为:Na>Mg>Al,故B错误;
C.单质的还原性Na>Mg>Al,则离子的还原性Na+<Mg2+<Al3+,故C错误;
D.同一周期中,原子序数越大,金属性越弱,单质的还原性越弱,则单质的还原性:Na>Mg>Al,故D错误;
故选A.
点评 本题考查了原子结构与元素周期律的应用,题目难度不大,明确元素周期律内容为解答关键,注意掌握原子结构与元素周期律、元素周期表的关系.

练习册系列答案
相关题目
19.不能鉴别乙醇溶液和乙酸溶液的试剂是( )
| A. | 氢氧化铜 | B. | 碳酸氢钠 | C. | 石蕊溶液 | D. | 金属钠 |
20.如图分别表示冰晶体、干冰晶体、金刚石晶体结构,关于这些晶体的说法正确的是( )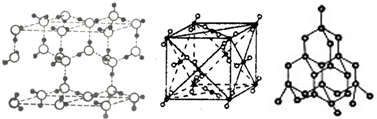

| A. | 冰晶体中只存在分子间作用力和氢键 | |
| B. | 沸点:金刚石>干冰>冰 | |
| C. | 冰晶体中的氧原子和金刚石中的碳原子可形成四面体结构 | |
| D. | 干冰晶体中每个CO2周围等距离且最近的CO2有10 个 |
17.将SO2气体通入BaCl2溶液至饱和,无沉淀生成,再通入气体甲有白色沉淀生成,则气体甲可能是( )
| A. | NO | B. | NH3 | C. | CO2 | D. | HCl |
14.从柑橘中可提炼出 .下列关于它的说法不正确的是( )
.下列关于它的说法不正确的是( )
 .下列关于它的说法不正确的是( )
.下列关于它的说法不正确的是( )| A. | 分子式为C10H16 | |
| B. | 1mol该有机物能与4mol H2发生加成反应 | |
| C. | 能与溴水发生加成反应 | |
| D. | 常温下呈液态,难溶于水 |
1.短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Z为地壳中含量最高的金属元素.下列说法正确的是( )
| X | ||||||
| Y | Z | W |
| A. | 工业上电解YW饱和溶液冶炼金属Y | |
| B. | 气态氢化物的稳定性:W>X | |
| C. | Y、W的最高价氧化物的水化物均能溶解金属Z | |
| D. | 简单离子半径的大小顺序:r(Y+)>r(X-) |
18.不粘锅的内壁有一薄层,为聚四氟乙烯.用不粘锅烹烧饭菜是不易粘锅烧焦.下列关于聚四氟乙烯的说法正确的是( )
| A. | 聚四氟乙烯分子中含有双键 | |
| B. | 聚四氟乙烯的单体是不饱和烃 | |
| C. | 聚四氟乙烯的化学性质很稳定,正常使用时不会发生化学变化 | |
| D. | 聚四氟乙烯中的氟的质量分数约为76% |
19. 图表归纳是学习化学的一种常用方法,某同学归纳的下表中的物质及其所属类別与图的对应关系正确的是( )
图表归纳是学习化学的一种常用方法,某同学归纳的下表中的物质及其所属类別与图的对应关系正确的是( )
 图表归纳是学习化学的一种常用方法,某同学归纳的下表中的物质及其所属类別与图的对应关系正确的是( )
图表归纳是学习化学的一种常用方法,某同学归纳的下表中的物质及其所属类別与图的对应关系正确的是( )| 选项 | X | Y | Z |
| A | 胶体 | 混合物 | 淀粉溶液 |
| B | 化合物 | 酸性氧化物 | 一氧化氮 |
| C | 气态氢化物 | 化合物 | 液溴 |
| D | 强电解质 | 强酸 | 硫酸 |
| A. | A | B. | B | C. | C | D. | D |