题目内容
6.饮用水的消毒剂有多种,其中杀菌能力强且不会影响水质的理想消毒剂是( )| A. | 臭氧 | B. | 漂白粉 | C. | 液氯 | D. | 明矾 |
分析 根据消毒剂能杀菌消毒且不能影响水的酸碱性、不能有毒分析.
A、臭氧具有强氧化性;
B、漂白粉菌杀菌消毒是利用其强氧化性;
C、液氯是有毒物质,能和水反应生成盐酸和次氯酸,次氯酸有强氧化性;
D、明矾溶解后溶液中铝离子水解生成氢氧化铝胶体能吸附悬浮杂质净水.
解答 解:A、臭氧具有强氧化性,所以能杀菌消毒,且不影响水质,故A正确;
B、漂白粉菌杀菌消毒是利用了次氯酸钠的强氧化性,次氯酸钠是强碱弱酸盐,所以影响水质,故B错误;
C、液氯能和水反应生成盐酸和次氯酸,次氯酸有强氧化性所以能杀菌消毒,但因有盐酸生成所以影响水质,故C错误;
D、明矾溶解后溶液中铝离子水解生成氢氧化铝胶体能吸附悬浮杂质净水,但不能杀菌消毒,故D错误.
故选A.
点评 本题考查了饮用水消毒剂的选取,题目难度不大,根据物质的性质分析其用途,注意化学知识的积累.

练习册系列答案
相关题目
6.向碘水中加入适量CCl4并振荡,静置后观察到的现象是( )
| A. | 形成均匀的无色溶液 | B. | 形成均匀的紫红色溶液 | ||
| C. | 液体分层,上下层均呈无色 | D. | 液体分层,下层呈紫红色 |
7.两种气态烃组成的混合物6.72L(标准状况),完全燃烧生成0.48molCO2和10.8g水,则该混合烃中( )
| A. | 一定不存在乙烯 | B. | 一定不存在甲烷 | C. | 一定存在甲烷 | D. | 一定存在乙烯 |
14.已建立平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列叙述正确的是( )
①生成物的质量分数一定增加 ②生成物的产量一定增加
③反应物的转化率一定增加 ④平衡时反应物的浓度一定降低
⑤正反应速率一定大于逆反应速率 ⑥可能是使用了催化剂.
①生成物的质量分数一定增加 ②生成物的产量一定增加
③反应物的转化率一定增加 ④平衡时反应物的浓度一定降低
⑤正反应速率一定大于逆反应速率 ⑥可能是使用了催化剂.
| A. | ①②⑤ | B. | ④⑥ | C. | ②⑤ | D. | ③④⑤ |
18.下列说法正确的是( )
| A. | 一定温度下,10mL 0.50mol•L-1NH4Cl溶液与20mL 0.25mol•L-1NH4C1溶液含NH4+物质的量相同 | |
| B. | 25℃时,将a mo1•L-l氨水与0.01 moI•L-1盐酸等体积混合,反应完全时溶液中c(NH4+)=c(C1-),用含a的代数式表示反应完全时NH3•H2O的电离常数Kb=$\frac{1{0}^{-9}}{a-0.01}$ | |
| C. | 某酸式盐NaHA溶液中一定有:c(OH-)+c(A2-)=c(H+)+c(H2A) | |
| D. | 等体积、pH都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说明酸性:HA>HB |
15.某无色溶液中加入氢氧化铝,氢氧化铝迅速溶解,则该溶液中一定能大量共存的离子组是( )
| A. | K+、Na+、NO3-、Cl- | B. | Na+、NH4+、SO42-、Cl- | ||
| C. | Na+、K+、I-、NO3- | D. | Na+、K+、MnO4-、Br- |
16.制取水处理剂ClO2的化学方程式为:2KClO3+H2C2O4+H2SO4═2ClO2↑+K2SO4+2CO2↑+2H2O.下列说法不正确的是( )
| A. | KClO3在反应中得到电子 | |
| B. | ClO2是还原产物 | |
| C. | H2C2O4在反应中被还原 | |
| D. | 1molKClO3参加反应有1mol电子转移 |
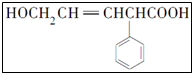 写出该有机物结构中含氧官能团的名称羟基、羧基.
写出该有机物结构中含氧官能团的名称羟基、羧基.