题目内容
11.(1)某有机物的结构简式为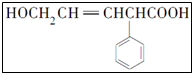 写出该有机物结构中含氧官能团的名称羟基、羧基.
写出该有机物结构中含氧官能团的名称羟基、羧基.(2室温下,以惰性电极电解100mL 0.1mol/LNaCl溶液,写出电解总反应的化学方程式2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2NaOH;若阴阳两极均得到112mL气体(标准状况),则所得溶液的pH为13(忽略反应前后溶液的体积变化).
(3)某学生用中和滴定法测定某NaOH溶液的物质的量浓度,选酚酞作指示剂.盛装0.2000mol/L盐酸标准液应该用酸式滴定管;用盐酸滴定待测液NaOH,滴定终点时的颜色变化是浅无色变为无色且30s不变色;滴定前用待测液润洗形瓶,则所测NaOH溶液的浓度偏高(填“无影响”、“偏高”或“偏低”下同);若滴定前平视读数,滴定终点时俯视读数,则会使所测NaOH溶液的浓度值偏低.
分析 (1)该有机物分子中含有的官能团为:碳碳双键、羧基和羟基,含氧官能团为羟基和羧基;
(2)电解氯化钠溶液生成氯气、氢气和氢氧化钠,由电解方程式可计算出氢氧根的浓度,进而算出pH;
(3)盐酸为酸溶液,应该用酸式滴定管;根据滴定前为红色,滴定结束时为无色判断滴定终点时的现象;滴定前用待测液润洗形瓶,导致待测液的物质的量增大,测定结果偏高;滴定终点时俯视读数,导致读出的标准液体积偏小,测定结果偏低.
解答 解:(1)有机物 含有的含氧官能团为羟基和羧基,
含有的含氧官能团为羟基和羧基,
故答案为:羟基、羧基;
(2)电解饱和食盐水在阴极得到氢气,阳极得到氯气,反应方程式为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2NaOH;
生成氯气的物质的量为:$\frac{0.112l}{22.4L/mol}$=0.005mol,由2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2NaOH 可知:Cl2↑~H2↑~2NaOH,
则n(NaOH)=2n(Cl2)=2×0.005mol=0.01mol,氢氧化钠溶液的浓度为:c(NaOH)═0.1mol/L,所以溶液的pH=13,
故答案为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2NaOH;13;
(3)盐酸为强酸,盛装0.2000mol/L盐酸标准液应该用酸式滴定管;用盐酸滴定待测液NaOH,接近滴定终点时溶液为浅红色,滴定终点时为无色,则滴定终点时溶液的颜色变化是:浅红色变为无色且30s不变色;
滴定前用待测液润洗形瓶,导致待测液的物质的量偏大,则所测NaOH溶液的浓度偏高;
若滴定前平视读数,滴定终点时俯视读数,导致滴定终点的读数偏小,则会使所测NaOH溶液的浓度值偏低,
故答案为:酸;浅红色变为无色;偏高;偏低.
点评 本题考查了电解原理、中和滴定原理及有机物官能团判断等知识,题目难度中等,明确中和滴定原理为解答关键,注意掌握电解原理及其应用方法,试题培养了学生的灵活应用能力.

| A. | 液氯 | B. | 氯水 | ||
| C. | NaClO溶液 | D. | Na2O2与水反应后的溶液 |
| A. | $\frac{1}{54}$ | B. | $\frac{1}{6.75}$ | C. | $\frac{1}{27}$ | D. | 1 |
| A. | 臭氧 | B. | 漂白粉 | C. | 液氯 | D. | 明矾 |
| A. |  玛瑙 | B. |  光导纤维 | C. |  太阳能电池板 | D. |  水晶 |
| A. | 可以确定该微粒为Ne | |
| B. | 对应元素可能位于元素周期表中第13列 | |
| C. | 它的单质可能是强还原剂 | |
| D. | 对应元素可能是电负性最大的元素 |
| B | C |
| D |
| A. | 简单离子的半径大小关系:C>E | |
| B. | D元素的气态氢化物比C元素的气态氢化物稳定 | |
| C. | 由B、E可组成离子化合物,阴、阳离子个数比为1:1或1:2 | |
| D. | 由C、D、E中的二种元素组成的化合物,溶液显中性或碱性 |

