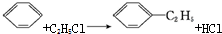
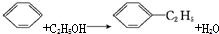
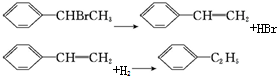
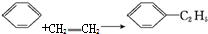题目内容
5.用NA表示阿伏加德罗常数的值,下列说法正确的是( )| A. | 一个水分子的质量为18NA g | |
| B. | 常温常压下,22.4L氯气与足量金属钠充分反应,转移的电子数为2 NA | |
| C. | 1mol•L-1 CaCl2溶液中所含Ca2+离子的数目为NA | |
| D. | 通常状况下,32g 混合气体(O2和O3 )所含的氧原子数一定为2NA |
分析 A.水的相对分子质量为18,则1mol水的质量为18g;
B.常温常压下,气体摩尔体积大于22.4L/mol;
C.不知道溶液的体积;
D.依据氧元素守恒计算物质的量n=$\frac{m}{M}$,确定氧原子数.
解答 解:A.水的相对分子质量为18,则1mol水的质量为18g,1mol水的分子数为NA个,则一个水分子的质量为$\frac{18}{N{\;}_{A}}$g,故A错误;
B.常温常压下,气体摩尔体积大于22.4L/mol,故22.4L氯气的物质的量小于1mol,则与金属钠反应后转移的电子小于2NA个,故B错误;
C.不知道溶液的体积,无法计算,故C错误;
D.氧元素守恒,32g O2和O3混合气体含氧原子数=$\frac{32g}{16g/mol}$×NA=2NA,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
13.下列反应的离子方程式正确的是( )
| A. | 氨气通入醋酸溶液 CH3COOH+NH3═CH3COONH4 | |
| B. | 澄清的石灰水跟盐酸反应 H++OH-═H2O | |
| C. | 碳酸钡溶于醋酸 BaCO3+2H+═Ba2++H2O+CO2↑ | |
| D. | 金属钠跟水反应 Na+H2O═Na ++OH-+H2↑ |
20.比较下列物质的稳定性,正确的是( )
| A. | Na2O>Na2O2 | B. | Na2CO3>NaHCO3>H2CO3 | ||
| C. | Na2SO4•10H2O>Na2CO3•10H2O | D. | NaClO>NaCl>NaF |
10.向下列各离子组的溶液中通入足量相应气体后,各离子还能大量存在的是( )
| A. | 氯气:Na+、Ba2+、HSO3-、I- | B. | 二氧化碳:Ca2+、NO3-、Ba2+、Cl- | ||
| C. | 氨气:Fe3+、Al3+、Na+、NO3- | D. | 二氧化硫:Ba2+、K+、NO3-、Cl- |
17.下列化学反应的离子方程式书写正确的是( )
| A. | 用小苏打治疗胃酸过多:HCO3-+H+═CO2↑+H2O | |
| B. | Ca(HCO3)2溶液与过量NaOH溶液反应:HCO3-+OH-═CO32-+H2O | |
| C. | 利用腐蚀法制作印刷线路板:Fe3++Cu═Fe2++Cu2+ | |
| D. | 钠与水反应:Na+H2O═Na++OH-+H2↑ |
15.图为番茄电池的示意图,下列说法正确的是( )
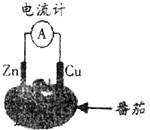

| A. | 电流由锌通过导线流向铜 | B. | 负极反应为Zn-2e-=Zn2+ | ||
| C. | 一段时间后,铜片质量会减少 | D. | 一段时间后,锌片质量会增加 |