题目内容
12.在实验室中可根据NaHCO3、NaCl、NH4Cl等物质溶解度的差异,利用饱和食盐水、氨气和二氧化碳反应,获得碳酸氢钠晶体.反应原理可用如下化学方程式表示:NH3+CO2+NaCl(饱和)+H2O-NH4Cl+NaHCO3(晶体)某校学习小组欲依据此原理制备碳酸氢钠晶体,他们设计了如下实验装置,其中B装置中的试管内是溶有氨气的氯化钠溶液,且二者均已达到饱和:

(1)A装置中所发生反应的离子方程式为CaCO3+2H+=Ca2++CO2↑+H2O;C装置中稀硫酸的作用为吸收从B装置中的试管内逸出的氨气,减少对环境的污染.
(2)如表中所列出的是相关物质在不同温度下的溶解度数据(g/100g水).
| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | |
| NaCl | 35.7 | 35.8 | 36 | 36.3 | 36.6 | 37 |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
(3)该校学生在检查完此套装置气密性后进行试验,结果没有得到碳酸氢钠晶体,指导教师指出应在AB(填写字母)装置之间连接一个盛有饱和碳酸氢钠溶液的洗气装置,其作用是除去二氧化碳气体中的氯化氢气体.
(4)同学们利用改进后的装置进行试验,在B中的试管内析出了晶体,经过必要的操作后得到了一种纯净的晶体.现有下列试剂:盐酸、浓氨水、生石灰、蒸馏水,请利用本题所提供的试剂(只限一种)及试管、酒精灯等主要仪器,通过简单试验判断该晶体是碳酸氢钠晶体,而不是碳酸氢铵或食盐晶体,简述操作方法、试验现象及结论:取少量晶体置于试管中,在酒精灯上加热使其充分反应后,还有白色固体剩余,则晶体不是NH4HCO3.
(5)该小组同学为了测定B中所得的碳酸氢钠晶体的纯度(假设晶体中不含碳酸盐杂质),将晶体充分干燥后,称量质量为w g,再将晶体加热到质量不再发生变化,称量所得粉末质量为m g.然后进行如图所示实验:

①操作Ⅱ中,为了判断加入的氯化钙溶液是否过量,下列操作中正确的是C(选填字母序号).
A.在加入氯化钙溶液后,振荡、静置,向溶液中继续加入少量氯化钙溶液
B.在加入氯化钙溶液后,振荡、静置,向溶液中继续加入少量碳酸钠溶液
C.在加入氯化钙溶液后,振荡、静置,取上层清液,加入少量碳酸钠溶液
②操作Ⅲ的方法为过滤、洗涤、干燥.
③所得晶体中碳酸氢钠的纯度为$\frac{168n}{w}$%.
分析 (1)A装置是指取二氧化碳气体的装置,是碳酸钙和盐酸发生反应生成氯化钙、水和二氧化碳;C装置稀硫酸是尾气处理装置吸收过量的氨气;
(2)B装置中的试管内是溶有氨和氯化钠的饱和溶液,通入二氧化碳气体会发生反应生成碳酸氢钠和氯化铵,温度越低越有利于碳酸氢钠的晶体析出;
(3)通入二氧化碳没有得到碳酸氢钠晶体,是二氧化碳气体中含有氯化氢气体,通入后和氨气反应不能生成碳酸氢钠,所以需要加一个洗气装置用饱和碳酸氢钠溶液除去二氧化碳中的氯化氢气体;
(4)碳酸氢钠受热分解为碳酸钠、水、二氧化碳,碳酸氢铵受热分解为氨气、水、二氧化碳,根据加热后的产物判断;
(5)测定C中所得晶体的碳酸氢钠的纯度(假设晶体中不含碳酸盐杂质),将晶体充分干燥后,称量质量为wg,此时为碳酸氢钠粗品质量,操作1将晶体加热到质量不再变化时,所得粉末为碳酸钠和杂质,然后溶解,加入氯化钙溶液,氯化钙跟碳酸钠反应生成碳酸钙,将生成的碳酸钙过滤、洗涤、干燥,称量为n g,根据关系式2NaHCO3--CaCO3可求出纯碳酸氢钠的质量.
①操作Ⅱ中,加入氯化钙溶液会有白色沉淀生成,当氯化钙过量时,就不会再生成沉淀;
②从溶液里得到不溶性的固体碳酸钙可选择过滤,再进行洗涤、干燥;
③根据反应过程中碳原子守恒,利用生成碳酸钙的物质的量计算样品中碳酸氢钠的质量,再计算纯度.
解答 解:(1)A装置是指取二氧化碳气体的装置,是碳酸钙和盐酸发生反应生成氯化钙、水和二氧化碳;反应的离子方程式为:CaCO3+2H+=Ca2++CO2↑+H2O;C装置稀硫酸是尾气处理装置吸收过量的氨气,防止污染环境;
故答案为:CaCO3+2H+=Ca2++CO2↑+H2O;吸收从B装置中的试管内逸出的氨气,减少对环境的污染;
(2)B装置中的试管内是溶有氨和氯化钠的饱和溶液,通入二氧化碳气体会发生反应生成碳酸氢钠和氯化铵,依据图标分析可知温度越低,碳酸氢钠的溶解度越小,所以温度越低越有利于碳酸氢钠的晶体析出;
故答案为:温度越低碳酸氢钠溶解度越小,便于析出;
(3)二氧化碳气体中含有氯化氢气体,通入后和氨气反应不能生成碳酸氢钠,所以的不到碳酸氢钠晶体,所以需要加一个洗气装置用饱和碳酸氢钠溶液除去二氧化碳中的氯化氢气体;
故答案为:AB;饱和碳酸氢钠溶液;除去二氧化碳气体中的氯化氢气体;
(4)碳酸氢钠在加热的条件下生成碳酸钠、水和二氧化碳,反应为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,有白色固体碳酸钠剩余,碳酸氢铵(NH4HCO3)受热分解,生成氨气(NH3)、二氧化碳和水,反应的化学方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,无固体剩余,所以判断该晶体是碳酸氢钠晶体而不是碳酸氢铵晶体,方法为:取少量晶体置于试管中,在酒精灯上加热使其充分反应后,还有白色固体剩余,则晶体不是NH4HCO3,
故答案为:取少量晶体置于试管中,在酒精灯上加热使其充分反应后,还有白色固体剩余,则晶体不是NH4HCO3;
(5)测定C中所得晶体的碳酸氢钠的纯度(假设晶体中不含碳酸盐杂质),将晶体充分干燥后,称量质量为wg,此时为碳酸氢钠粗品质量,操作1将晶体加热到质量不再变化时,所得粉末为碳酸钠和杂质,然后溶解,加入氯化钙溶液,氯化钙跟碳酸钠反应生成碳酸钙,将生成的碳酸钙过滤、洗涤、干燥,称量为n g,所此作答;
①为判断滴加的氯化钙溶液过量,可在加入氯化钙溶液后,振荡、静置,取上层清液再加入少量氯化钙溶液看是否有沉淀生成,故答案为:C;
②利用过滤、洗涤、干燥可从混合液中得到不溶性的碳酸钙沉淀,故答案为:过滤;洗涤;干燥;
③反应的化学方程式为①2NaHCO3$\frac{\underline{\;加热\;}}{\;}$Na2CO3+CO2↑+H2O,②Na2CO3+CaCl2=CaCO3 ↓+H2O+2NaCl,得到的碳酸钙需要经过过滤、洗涤、干燥后方可称量.
设样品中碳酸氢钠的质量为x,由上两式可得关系式:
2NaHCO3--CaCO3
84×2 100
x n
$\frac{84×2}{x}=\frac{100}{n}$,x=$\frac{168n}{100}$ g,
碳酸氢钠的质量分数为$\frac{x}{w}$×100%=$\frac{\frac{168n}{100}}{w}$×100%=$\frac{168n}{w}$%,
故答案为:$\frac{168n}{w}$%.
点评 本题考查了侯氏制碱的反应原理和实验设计和操作,物质质量分数的计算,明确各原料的制备方法及尾气处理是解题的关键,难度中等,侧重对学生分析问题的能力和计算能力的考查.

 阅读快车系列答案
阅读快车系列答案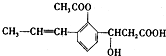 ,下列有关该有机化合物的说法不正确的是
,下列有关该有机化合物的说法不正确的是( )
| A. | 含有四种官能团 | |
| B. | 能发生取代、加成、消去、氧化等反应• | |
| C. | 1mol该有机物最多可以与2molNaOH反应 | |
| D. | 该有机物属于芳香族化合物 |
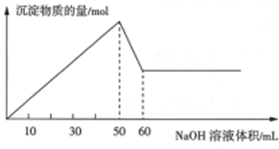
 在t℃时,AgCl在水中的沉淀溶解平衡曲线如图所示(假设AgCl饱和溶液的密度与水的密度近似相等).下列说法错误的是( )
在t℃时,AgCl在水中的沉淀溶解平衡曲线如图所示(假设AgCl饱和溶液的密度与水的密度近似相等).下列说法错误的是( )| A. | 在t℃时,AgCL的Ksp为4×10-10 | |
| B. | 在t℃时,c点溶液中一定有AgCl沉淀析出 | |
| C. | 在t℃时,AgCl的溶解度约为2.9×10-4g | |
| D. | d点溶液,温度升高后c(Ag+)、c(Cl-)均不变 |

②
| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环乙醇 | 0.96 | 25.93 | 161 | 能溶于水 |
| 环乙烯 | 0.81 | -103 | 83 | 难溶于水 |
(1)制备粗品将12.5mL环乙醇加入试管A中,在加入1mL浓硫酸,摇匀,放入碎瓷片,缓慢加热至反应完全,在试管C内得到环乙烯粗品.试管C置于冰水浴中的目的是使环己烯液化,减少挥发.
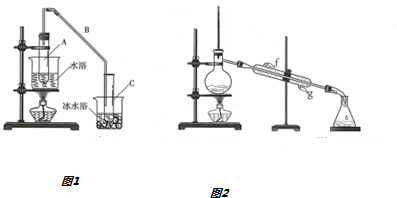
(2)制备精品
①环乙烯粗品中含有环乙醇和少量有机酸性杂质等.加入饱和食盐水,振荡、静置、分层,环乙烯在上层(填“上”或“下”)层,分液后用c(填字母序号)洗涤.
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再次分液,并用无水氯化钙干燥,过滤后再按图2装置蒸馏,冷凝水从g(填字母)口进入
③收集产品时,控制的温度应在83℃,实验制得的环乙烯精品质量低于理论产量,可能的原因是B(填字母序号)
A.蒸馏时从70℃开始收集产品
B.制备粗品时环乙醇随产品一起蒸出.
| A. | 6 | B. | 5 | C. | 4 | D. | 1 |
| A. | 标准状况下,1 mol NO与0.5 mol O2混合后气体的体积为22.4 L | |
| B. | 1L 0.5 mol•L-1 NaF溶液中含有的F-数目为0.5NA | |
| C. | 7.8g Na2S和Na2O2晶体混合物中共含有0.1NA个阴离子 | |
| D. | 12g石墨晶体中正六边形的数目为3NA |