题目内容
5.在通常条件下,下列各组物质的性质排列不正确的是( )| A. | 沸点:乙烷>戊烷>2甲基丁烷 | B. | 同分异构体种类:戊烷<戊烯 | ||
| C. | 密度:苯<水<1,1,2,2四溴乙烷 | D. | 点燃时火焰明亮程度:乙烯>乙烷 |
分析 A.烷烃中碳原子个数越多其熔沸点越高,同分异构体中支链越多其熔沸点越低;
B.戊烯不但有碳链异构,还有官能团异构和位置异构;
C.苯的密度小于1g/mL、水的密度是1g/mL、1,1,2,2-四溴乙烷的密度大于1g/mL;
D.碳的百分含量越高,火焰越明亮.
解答 解:A.烷烃中碳原子个数越多其熔沸点越高,同分异构体中支链越多其熔沸点越低,所以这几种烷烃的熔沸点戊烷>2-甲基丁烷>乙烷,故A错误;
B.戊烷只有碳链异构,戊烯不但有碳链异构,还有官能团异构和位置异构,故同分异构体种类戊烷<戊烯,故B正确;
C.苯的密度小于1g/mL、水的密度是1g/mL、1,1,2,2-四溴乙烷的密度大于1g/mL,所以密度苯<水<1,1,2,2-四溴乙烷,故C正确;
D.碳的百分含量越高,火焰越明亮,更由于乙烯中碳的百分含量高于乙烷,故火焰的明亮程度乙烯高于乙烷,故D正确.
故选A.
点评 本题考查物质的性质比较,熟悉影响有机物沸点的原因、影响同分异构体种类的因素和有机物的密度是解答本题的关键,注意归纳规律性知识来解答,难度不大.

练习册系列答案
相关题目
15.下列说法正确的是( )
| A. | 16O2和17O2都是氧的同素异形体 | |
| B. | 金属氧化物都是碱性氧化物 | |
| C. | 烟和雾可发生丁达尔现象,都属于胶体 | |
| D. | 合成纤维和光导纤维都是无机非金属材料 |
16.镁-空气电池的工作原理如图所示.下列说法不正确的是( )
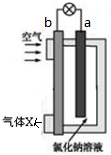

| A. | 工作一段时间后,c(Na+)变大 | |
| B. | 电池工作时,OH-向a极移动 | |
| C. | 气体X 中N2的百分含量与空气相同 | |
| D. | 电池总反应为2Mg+O2+2H2O═2 Mg(OH)2 |
13.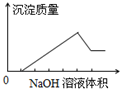 在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入NaOH溶液体积的关系如图所示,由此确定,原溶液中含有的离子可能是( )
在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入NaOH溶液体积的关系如图所示,由此确定,原溶液中含有的离子可能是( )
 在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入NaOH溶液体积的关系如图所示,由此确定,原溶液中含有的离子可能是( )
在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入NaOH溶液体积的关系如图所示,由此确定,原溶液中含有的离子可能是( )| A. | Mg2+、Al3+、Fe3+ | B. | H+、Mg2+、Al3+ | C. | H+、Ba2+、Al3+ | D. | Na+、Mg2+、Al3+ |
10.金可溶于王水(浓硝酸与浓盐酸的混合物):Au+HNO3+4HCl═HAuCl4+NO↑+2H2O,关于上述反应的有关说法错误的是( )
| A. | 盐酸作氧化剂 | B. | HNO3被还原 | ||
| C. | 王水有很强的氧化性 | D. | HAuCl4中Au的化合价为+3价 |
17.下列反应属于吸热反应的是( )
| A. | 酸碱中和反应 | B. | 葡萄糖在人体内氧化分解 | ||
| C. | Ba(OH)2•8H2O与NH4Cl反应 | D. | 锌粒与稀H2SO4反应制取H2 |
1.下列选项正确的是( )
| A. | 0.1 mol•L-1的NaHCO3溶液中:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) | |
| B. | 等物质的量浓度的三种溶液:①(NH4)2SO4、②NH4Cl、③NH3•H2O中,c(NH4+)的大小顺序为:③>②>① | |
| C. | 25℃时,pH=4的KHC2O4溶液中:c(HC2O4-)>c(H2C2O4)>c(C2O22-) | |
| D. | CH3COONa溶液和盐酸混合呈中性的溶液中:c(Na+)>c(Cl-)=c(CH3COOH) |
 一定质量的镁、铝混合物投到2mol•L-1的盐酸中,待金属完全溶解后,向溶液中加入2mol•L-1的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示.则:
一定质量的镁、铝混合物投到2mol•L-1的盐酸中,待金属完全溶解后,向溶液中加入2mol•L-1的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示.则: