题目内容
10.金可溶于王水(浓硝酸与浓盐酸的混合物):Au+HNO3+4HCl═HAuCl4+NO↑+2H2O,关于上述反应的有关说法错误的是( )| A. | 盐酸作氧化剂 | B. | HNO3被还原 | ||
| C. | 王水有很强的氧化性 | D. | HAuCl4中Au的化合价为+3价 |
分析 该反应中Au元素化合价由0价变为+3价、N元素化合价由+5价变为+2价,得电子化合价降低的反应物是氧化剂、失电子化合价升高的反应物是还原剂,在反应中氧化剂被还原、还原剂被氧化,据此分析解答.
解答 解:该反应中Au元素化合价由0价变为+3价、N元素化合价由+5价变为+2价,得电子化合价降低的反应物是氧化剂、失电子化合价升高的反应物是还原剂,在反应中氧化剂被还原、还原剂被氧化,
A.通过以上分析知,Au是还原剂、硝酸是氧化剂,HCl体现酸性,故A错误;
B.该反应中硝酸是氧化剂,被还原,故B正确;
C.Au不活泼,但能被王水氧化,说明王水具有很强的氧化性,故C正确;
D.HAuCl4中Cl元素化合价为-1价、H元素化合价为+1价,所以Au的化合价为+3价,故D正确;
故选A.
点评 本题以王水和Au的反应为载体考查氧化还原反应,侧重考查基本概念及基本性质,明确元素化合价变化与氧化剂、还原剂关系是解本题关键,题目难度不大.

练习册系列答案
相关题目
20.下列说法中正确的是( )
| A. | 自发反应一定是熵增大,非自发反应一定是熵减小或不变 | |
| B. | Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小 | |
| C. | pH=5的CH3COOH溶液和PH=5的NH4Cl溶液中,c(H+)不相等 | |
| D. | 在Na2S溶液中加入AgCl固体,溶液中c(S2-)下降 |
1.有些科学家提出硅是“21 世纪的能源”,这主要是由于作为半导体材料的硅在太阳能发电过程中具有重要的作用.下列关于硅及其化合物的说法正确的是( )
| A. | 水泥、玻璃、水晶饰物都是硅酸盐制品 | |
| B. | 高温下,可在试管内完成焦炭和石英砂(SiO2)制取硅的反应 | |
| C. | 光导纤维的主要成分是SiO2 | |
| D. | 自然界中硅元素的贮量丰富,并存在大量的单质硅 |
18.下列各组中互为同系物的是( )
| A. | 甲烷和丙烷 | B. |  和 和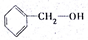 | C. | 2-丙醇和1-丙醇 | D. | 2-丁烯和丙烯 |
5.在通常条件下,下列各组物质的性质排列不正确的是( )
| A. | 沸点:乙烷>戊烷>2甲基丁烷 | B. | 同分异构体种类:戊烷<戊烯 | ||
| C. | 密度:苯<水<1,1,2,2四溴乙烷 | D. | 点燃时火焰明亮程度:乙烯>乙烷 |
15.为了除去CuCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入一种试剂,过滤后再向滤液中加入适量盐酸.这种试剂是( )
| A. | 稀氨水 | B. | NaOH溶液 | C. | 硫氰化钾溶液 | D. | Cu2(OH)2CO3固体 |
19.下列物质的俗名与化学式不对应的是( )
| A. | 硅石--SiO2 | B. | 硫铁矿--FeS2 | ||
| C. | 纯碱--NaOH | D. | 芒硝--Na2SO4•10H2O |
6.下列关于碳酸钠和碳酸氢钠的比较中,错误的是( )
| A. | 二者在一定的条件下可以相互转化 | |
| B. | 二者热稳定性不同,碳酸钠的热稳定性大于碳酸氢钠的热稳定性 | |
| C. | 等质量的碳酸钠与碳酸氢钠与足量盐酸反应,后者现象更剧烈,但前者产生的二氧化碳多 | |
| D. | 将二氧化碳通入到饱和碳酸钠溶液中,会有浑浊产生 |