题目内容
13.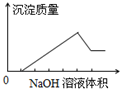 在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入NaOH溶液体积的关系如图所示,由此确定,原溶液中含有的离子可能是( )
在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入NaOH溶液体积的关系如图所示,由此确定,原溶液中含有的离子可能是( )| A. | Mg2+、Al3+、Fe3+ | B. | H+、Mg2+、Al3+ | C. | H+、Ba2+、Al3+ | D. | Na+、Mg2+、Al3+ |
分析 根据沉淀的质量与加入的NaOH溶液体积的关系图示可知,开始时没有沉淀,之后逐渐生成沉淀,达到沉淀最大量后有部分溶解,说明溶液中一定含有Al3+,还含有不溶于氢氧化钠的白色沉淀.
解答 解:A.由于是“无色溶液”,故一定没有Fe3+,故A错误;
B.根据图示,先加入氢氧化钠溶液,没有现象,之后逐渐生成氢氧化镁、氢氧化铝沉淀,最后氢氧化铝溶解,符合条件,故B正确;
C.由于图示中,一定有不溶于氢氧化钠的沉淀,H+、Ba2+、Al3+离子加入过量氢氧化钠,没有沉淀生成,故C错误;
D.图象中开始是没有沉淀生成,Na+、Mg2+、Al3+离子中加入氢氧化钠就会生成沉淀,故D错误;
故选B.
点评 本题考查了常见离子的检验方法,题目难度中等,明确常见离子的性质为解答关键,注意熟练掌握常见离子的检验方法,试题培养了学生的分析、理解能力及灵活应用能力.

练习册系列答案
相关题目
3.下列溶液中的Cl-浓度与100mL 2mol•L-1 MgCl2溶液中的Cl-浓度相等的是( )
| A. | 150 mL 1 mol•L-1 NaCl溶液 | B. | 75 mL 1 mol•L-1AlCl3溶液 | ||
| C. | 75 mL 2 mol•L-1CaCl2溶液 | D. | 200 mL 2 mol•L-1 KCl溶液 |
4.下列对实验方案的评价合理的是( )
| 选项 | 实验方案 | 评价 |
| A | 除去溴苯中的少量溴单质:用NaOH溶液洗涤、分液 | 错误,Br2不会与NaOH溶液反应 |
| B | 分离乙醇和乙酸:加入过量氢氧化钠,蒸馏分离出乙醇,再加入过量浓硫酸,蒸馏分离出乙酸 | 错误,直接蒸馏即可分离得到纯净的乙醇和乙酸 |
| C | 提取饱和碘水中的碘单质:用乙醇萃取 | 正确,单质碘易溶于乙醇等有机溶剂 |
| D | 除去乙烷中混有的少量乙烯:用溴水洗气 | 正确,乙烯能与溴水发生加成反应 |
| A. | A | B. | B | C. | C | D. | D |
1.有些科学家提出硅是“21 世纪的能源”,这主要是由于作为半导体材料的硅在太阳能发电过程中具有重要的作用.下列关于硅及其化合物的说法正确的是( )
| A. | 水泥、玻璃、水晶饰物都是硅酸盐制品 | |
| B. | 高温下,可在试管内完成焦炭和石英砂(SiO2)制取硅的反应 | |
| C. | 光导纤维的主要成分是SiO2 | |
| D. | 自然界中硅元素的贮量丰富,并存在大量的单质硅 |
8.A、B属于短周期中不同主族的元素,A、B原子的最外层电子中,成对电子和未成对电子占据的轨道数相等,若A元素的原子序数为a,则B元素的原子序数可能为( )
| A. | a-4 | B. | a+8 | C. | a-5 | D. | a+4 |
18.下列各组中互为同系物的是( )
| A. | 甲烷和丙烷 | B. |  和 和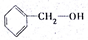 | C. | 2-丙醇和1-丙醇 | D. | 2-丁烯和丙烯 |
5.在通常条件下,下列各组物质的性质排列不正确的是( )
| A. | 沸点:乙烷>戊烷>2甲基丁烷 | B. | 同分异构体种类:戊烷<戊烯 | ||
| C. | 密度:苯<水<1,1,2,2四溴乙烷 | D. | 点燃时火焰明亮程度:乙烯>乙烷 |
3.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 24g镁的原子最外层电子数为NA | |
| B. | 0.3mol O2与一定量的Fe3+在一定条件下完全反应,生成Fe2O3和Fe3O4的混合物,则转移电子数为1.2mol | |
| C. | 2L 0.1mol/L氯化铁溶液中含有Fe的数目为0.2NA | |
| D. | 1L水中溶解了58.5gNaCl,该溶液的物质的量浓度为1mol/L |