题目内容
早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素组成.回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过 方法区别晶体、准晶体和非晶体.
(2)基态Fe原子有 个未成对电子,Fe3+的电子排布式为 .可用硫氰化钾检验Fe3+,形成的配合物的颜色为 .
(3)新制的Cu(OH)2可将乙醛(CH3CHO)氧化成乙酸,而自身还原成Cu2O.乙醛中碳原子的杂化轨道为 ,1mol乙醛分子中含有的σ键的数目为 .乙酸的沸点明显高于乙醛,其主要原因是 .Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和定点,则该晶胞中有 个铜原子.
(4)Al单质为面心立方晶体,晶胞中铝原子的配位数为 .
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过
(2)基态Fe原子有
(3)新制的Cu(OH)2可将乙醛(CH3CHO)氧化成乙酸,而自身还原成Cu2O.乙醛中碳原子的杂化轨道为
(4)Al单质为面心立方晶体,晶胞中铝原子的配位数为
考点:不同晶体的结构微粒及微粒间作用力的区别,原子核外电子排布,配合物的成键情况,原子轨道杂化方式及杂化类型判断
专题:
分析:(1)晶体对X射线发生衍射,非晶体不发生衍射,准晶体介于二者之间;
(2)根据Fe原子的核外电子排布式确定未成对电子数,失去电子变为铁离子时,先失去4s上的电子后失去3d上的电子,硫氰化铁为血红色;
(3)乙醛中甲基上的C采取sp3杂化类型,醛基中的C采取sp2杂化类型;1个乙醛分子含有6个σ键和一个π键;乙酸分子间可形成氢键导致沸点较高;根据O数目和Cu2O中Cu和O的比例计算晶胞中Cu原子的数目;
(4)在Al晶体的一个晶胞中与它距离相等且最近的Al原子在通过这个顶点的三个面心上,面心占
,通过一个顶点可形成8个晶胞.
(2)根据Fe原子的核外电子排布式确定未成对电子数,失去电子变为铁离子时,先失去4s上的电子后失去3d上的电子,硫氰化铁为血红色;
(3)乙醛中甲基上的C采取sp3杂化类型,醛基中的C采取sp2杂化类型;1个乙醛分子含有6个σ键和一个π键;乙酸分子间可形成氢键导致沸点较高;根据O数目和Cu2O中Cu和O的比例计算晶胞中Cu原子的数目;
(4)在Al晶体的一个晶胞中与它距离相等且最近的Al原子在通过这个顶点的三个面心上,面心占
| 1 |
| 2 |
解答:
解:(1)从外观无法区分三者,但用X光照射挥发现:晶体对X射线发生衍射,非晶体不发生衍射,准晶体介于二者之间,因此通过有无衍射现象即可确定,
故答案为:X射线衍射;
(2)26号元素Fe基态原子核外电子排布式为1s22s22p63s23p63d64s2,可知在3d上存在4个未成对电子,失去电子变为铁离子时,先失去4s上的2个电子后失去3d上的1个电子,因此Fe3+的电子排布式为1s22s22p63s23p63d5,硫氰化铁为血红色,
故答案为:4;1s22s22p63s23p63d5;血红色;
(3)乙醛中甲基上的C形成4条σ键,无孤电子对,因此采取sp3杂化类型,醛基中的C形成3条σ键和1条π键,无孤电子对,采取sp2杂化类型;1个乙醛分子含有6个σ键和一个π键,则1mol乙醛含有6molσ键,即6NA个σ键;乙酸分子间可形成氢键,乙醛不能形成氢键,所以乙酸的沸点高于乙醛;该晶胞中O原子数为4×1+6×
+8×
=8,由Cu2O中Cu和O的比例可知该晶胞中铜原子数为O原子数的2倍,即为16个;
故答案为:sp3、sp2;6NA;乙酸存在分子间氢键;16;
(4)在Al晶体的一个晶胞中与它距离相等且最近的Al原子在通过这个顶点的三个面心上,面心占
,通过一个顶点可形成8个晶胞,因此该晶胞中铝原子的配位数为8×3×
=12;
故答案为:12.
故答案为:X射线衍射;
(2)26号元素Fe基态原子核外电子排布式为1s22s22p63s23p63d64s2,可知在3d上存在4个未成对电子,失去电子变为铁离子时,先失去4s上的2个电子后失去3d上的1个电子,因此Fe3+的电子排布式为1s22s22p63s23p63d5,硫氰化铁为血红色,
故答案为:4;1s22s22p63s23p63d5;血红色;
(3)乙醛中甲基上的C形成4条σ键,无孤电子对,因此采取sp3杂化类型,醛基中的C形成3条σ键和1条π键,无孤电子对,采取sp2杂化类型;1个乙醛分子含有6个σ键和一个π键,则1mol乙醛含有6molσ键,即6NA个σ键;乙酸分子间可形成氢键,乙醛不能形成氢键,所以乙酸的沸点高于乙醛;该晶胞中O原子数为4×1+6×
| 1 |
| 2 |
| 1 |
| 8 |
故答案为:sp3、sp2;6NA;乙酸存在分子间氢键;16;
(4)在Al晶体的一个晶胞中与它距离相等且最近的Al原子在通过这个顶点的三个面心上,面心占
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:12.
点评:本题考查了晶体的性质、原子核外电子排布规律、共价键类型、氢键、杂化类型、晶胞配位数计算,综合性非常强,题目难度中等,其中晶胞配位数的计算是本题的难点.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案
相关题目
某无色溶液中可能含有I-、K+、Cu2+、SO32-(还原性:SO32->I-),向该溶液中加入少量溴水,溶液仍呈无色,则下列关于溶液组成的判断正确的是( )
①肯定不含I-; ②肯定不含Cu2+; ③肯定含有SO32-; ④可能含有I-.
①肯定不含I-; ②肯定不含Cu2+; ③肯定含有SO32-; ④可能含有I-.
| A、①③ | B、①②③ |
| C、②③④ | D、①② |
下列方程式书写正确的是( )
| A、醋酸的电离:CH3COOH+H2O?CH3COO-+H3O+ |
| B、H2SO3的电离方程式H2SO3?2H++SO32- |
| C、CO32-的水解方程式:CO32-+2H2O?H2CO3+2OH- |
| D、CaCO3的电离方程式:CaCO3?Ca2++CO32- |
下列互为同位素的是( )
A、
| ||||
| B、白磷和红磷 | ||||
| C、乙醇和甲醚 | ||||
D、
|
合成氨反应:N2(g)+3H2(g)?2NH3(g)△H,若该反应在一定条件下能自发,则有关该反应的△H、△S判断正确的是( )
| A、△H<0△S<0 |
| B、△H<0△S>0 |
| C、△H>0△S<0 |
| D、△H>0△S>0 |
常温下,pH相同的NaOH溶液和CH3COONa溶液分别加水稀释.pH随溶液体积变化的曲线如图所示,则下列叙述正确的是( )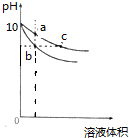

| A、b、c两点溶液的导电能力相同 |
| B、c点溶液中c (CH3COOH)+c(OH-)=c(H+) |
| C、a、b、c三点溶液中水的电离程度a>c>b |
| D、等体积的b、c两点溶液分别与相同浓度的盐酸恰好完全反应时,消耗盐酸的体积相等 |
化学科学需要借助化学专用语言描述,下列有关化学用语不正确的是( )
A、氯化钠的电子式: |
B、Cl-的结构示意图: |
| C、乙烯的结构式:C2H4 |
D、CH4分子的比例模型: |

 )也是一种重要的香料,主要用于食品、化妆品等工业中.请设计合理方案,以对异丙基苯甲醛(
)也是一种重要的香料,主要用于食品、化妆品等工业中.请设计合理方案,以对异丙基苯甲醛( )和丙醛为原料合成兔耳草醛(用合成路线流程图表示,并注明反应条件).
)和丙醛为原料合成兔耳草醛(用合成路线流程图表示,并注明反应条件).
 对氨基苯磺酸是制取某些染料和药物的重要中间体,可由苯胺磺化得到:
对氨基苯磺酸是制取某些染料和药物的重要中间体,可由苯胺磺化得到: