题目内容
8.串联电路中的四个电解池分别装有0.1mol•L-1的下列溶液,用铂电极电解,连接直流电源一段时间后,溶液的pH变小的是( )| A. | 盐酸 | B. | NaCl | C. | AgNO3 | D. | KNO3 |
分析 A.电解盐酸,发生反应:2HCl$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑,溶液中HCl浓度降低;
B.电解NaCl溶液,发生反应:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,有NaOH生成;
C.电解AgNO3溶液,发生反应:4AgNO3+2H2O$\frac{\underline{\;电解\;}}{\;}$4Ag+4HNO3+O2↑,有硝酸生成;
D.电解KNO3溶液,发生反应:2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑,KNO3浓度增大,但KNO3溶液为中性.
解答 解:A.电解盐酸,发生反应:2HCl$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑,溶液中HCl浓度降低,酸性减弱,溶液pH增大,故A错误;
B.电解NaCl溶液,发生反应:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,有NaOH生成,碱性增强,溶液pH增大,故B错误;
C.电解AgNO3溶液,发生反应:4AgNO3+2H2O$\frac{\underline{\;电解\;}}{\;}$4Ag+4HNO3+O2↑,有硝酸生成,酸性增强,溶液pH减小,故C正确;
C.电解KNO3溶液,发生反应:2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑,KNO3浓度增大,但KNO3溶液为中性,故D错误,
故选:C.
点评 本题考查电解原理,难度不大,关键是明确离子放电顺序及电极反应,有利于基础知识的巩固.

练习册系列答案
相关题目
16. 某温度时,卤化银(AgX,X=Cl,Br,I)的3条溶解平衡曲线如图所示,AgCl,AgBr,AgI的Ksp依次减小.已知pAg=-lgc(Ag+),pX=-lgc(X-),利用pX-pAg的坐标系可表示出 AgX的溶度积与溶液中的c(Ag+)和c(X-)的相互关系.下列说法错误的是( )
某温度时,卤化银(AgX,X=Cl,Br,I)的3条溶解平衡曲线如图所示,AgCl,AgBr,AgI的Ksp依次减小.已知pAg=-lgc(Ag+),pX=-lgc(X-),利用pX-pAg的坐标系可表示出 AgX的溶度积与溶液中的c(Ag+)和c(X-)的相互关系.下列说法错误的是( )
 某温度时,卤化银(AgX,X=Cl,Br,I)的3条溶解平衡曲线如图所示,AgCl,AgBr,AgI的Ksp依次减小.已知pAg=-lgc(Ag+),pX=-lgc(X-),利用pX-pAg的坐标系可表示出 AgX的溶度积与溶液中的c(Ag+)和c(X-)的相互关系.下列说法错误的是( )
某温度时,卤化银(AgX,X=Cl,Br,I)的3条溶解平衡曲线如图所示,AgCl,AgBr,AgI的Ksp依次减小.已知pAg=-lgc(Ag+),pX=-lgc(X-),利用pX-pAg的坐标系可表示出 AgX的溶度积与溶液中的c(Ag+)和c(X-)的相互关系.下列说法错误的是( )| A. | e点表示由过量的KI与AgNO3反应产生AgI沉淀 | |
| B. | A线是AgCl的溶解平衡曲线,C线是AgI的溶解平衡曲线 | |
| C. | d点是在水中加入足量的AgBr形成的饱和溶液 | |
| D. | 坐标点(8,4)形成的溶液是AgCl的不饱和溶液 |
3.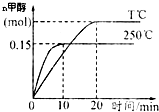 将1molCO和2molH2充入一容积为1L的密闭容器中,分别在250℃、T℃发生反应:CO(g)+2H2(g)?CH3OH(g)△H=akJ/mol,根据图示判断,下列结论正确的是( )
将1molCO和2molH2充入一容积为1L的密闭容器中,分别在250℃、T℃发生反应:CO(g)+2H2(g)?CH3OH(g)△H=akJ/mol,根据图示判断,下列结论正确的是( )
 将1molCO和2molH2充入一容积为1L的密闭容器中,分别在250℃、T℃发生反应:CO(g)+2H2(g)?CH3OH(g)△H=akJ/mol,根据图示判断,下列结论正确的是( )
将1molCO和2molH2充入一容积为1L的密闭容器中,分别在250℃、T℃发生反应:CO(g)+2H2(g)?CH3OH(g)△H=akJ/mol,根据图示判断,下列结论正确的是( )| A. | a<0,T<250 | |
| B. | 250℃时,0~10min内:v(H2)=0.015mol/(L•min) | |
| C. | CO的平衡转化率在250℃时比T℃大 | |
| D. | 250℃时,起始时向容器中改充1molCH3OH气体,恒温达平衡后,CH3OH的物质的量大于0.15mol |
13.某蓄电池放电、充电时的反应为Fe+Ni2O3+3H2O  Fe(OH)2+2Ni(OH)2下列推断中不正确的是( )
Fe(OH)2+2Ni(OH)2下列推断中不正确的是( )
①放电时,Fe为正极,Ni2O3为负极
②充电时,阴极上的电极反应式是Fe(OH)2+2e-═Fe+2OH-
③充电时,Ni(OH)2为阳极
④蓄电池的电极必须是浸在某种碱性电解质溶液中.
 Fe(OH)2+2Ni(OH)2下列推断中不正确的是( )
Fe(OH)2+2Ni(OH)2下列推断中不正确的是( )①放电时,Fe为正极,Ni2O3为负极
②充电时,阴极上的电极反应式是Fe(OH)2+2e-═Fe+2OH-
③充电时,Ni(OH)2为阳极
④蓄电池的电极必须是浸在某种碱性电解质溶液中.
| A. | ① | B. | ①②④ | C. | ①③④ | D. | ②③④ |
20.在相同的A、B密闭容器中分别充入2mol SO2和1mol O2,使它们在一定温度下反应,并达新平衡:2SO2+O2
?2SO3(g).若A容器保持体积不变,B容器保持压强不变.当A中SO2的转化率为25%时,B中SO2的转化率为( )
?2SO3(g).若A容器保持体积不变,B容器保持压强不变.当A中SO2的转化率为25%时,B中SO2的转化率为( )
| A. | 25% | B. | 大于25% | C. | 小于25% | D. | 无法判断 |
17.下列说法正确的是:( )
| A. | 工业上常使用电解精炼法将粗铜提纯,在电解精练时,阳极减少的质量等于阴极增加的质量 | |
| B. | 心脏起搏器中使用的新型Li-I2 电池的寿命已超过10年,其反应可简单表示为2Li+I2═2LiI,阴极反应为:2Li-2e-═2Li+ | |
| C. | 为了降低某水库的铁闸门被腐蚀的速率,其中焊接在铁闸门上的金属材料可以是锌 | |
| D. | 某物质的溶解度为难溶,则该物质不溶于水. |
18. 已知:①CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.2kJ/mol
已知:①CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.2kJ/mol
②CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=-247.4kJ/mol
(1)CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=+659.8 kJ/mol
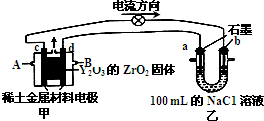
(2)科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航空航天.如图所示装置中,以稀土金属材料为惰性电极,在两极上分别通入甲烷和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导O2-.请回答下列问题:
①d电极上的反应式为CH4-8e-+4O2-=CO2+2H2O
②图乙是电解100mL 0.5mol/L的NaC1溶液,若a电极上产生112mL(标准状况)气体,则所得溶液的pH=13(不考虑溶液体积的变化).
(3)将一定量纯净的氨基甲酸铵置于真空密闭容器中(假设容器体积不变,固态试样体积忽略不计),在恒定的温度下使其分解达到平衡:
H2NCOONH4(s)═2NH3(g)+CO2(g).实验测得不同温度下的数据如表:
①氨基甲酸铵分解反应的焓变△H>0(填“>”、“<”或“=”).
②可以判断该分解反应已经达到化学平衡的是BC(填序号).
A.2υ(NH3)=υ(CO2) B.密闭容器中气体总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
③根据表中数据,计算25℃时氨基甲酸铵的分解平衡常数为1.64×10-8(mol/L)3(保留两位小数).
(4)25℃时,NH3•H2O电离常数K=1.8×10-5,Mg(OH)2的溶度积常数Ksp=1.8×10-11,在某MgC12溶液中加入一定量的某浓度的氨水后,测得混合液pH=11,计算此温度下残留在溶液中的c(Mg2+)=1.8×10-5mol/L.
 已知:①CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.2kJ/mol
已知:①CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.2kJ/mol②CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=-247.4kJ/mol
(1)CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=+659.8 kJ/mol
(2)科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航空航天.如图所示装置中,以稀土金属材料为惰性电极,在两极上分别通入甲烷和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导O2-.请回答下列问题:
①d电极上的反应式为CH4-8e-+4O2-=CO2+2H2O
②图乙是电解100mL 0.5mol/L的NaC1溶液,若a电极上产生112mL(标准状况)气体,则所得溶液的pH=13(不考虑溶液体积的变化).
(3)将一定量纯净的氨基甲酸铵置于真空密闭容器中(假设容器体积不变,固态试样体积忽略不计),在恒定的温度下使其分解达到平衡:
H2NCOONH4(s)═2NH3(g)+CO2(g).实验测得不同温度下的数据如表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
②可以判断该分解反应已经达到化学平衡的是BC(填序号).
A.2υ(NH3)=υ(CO2) B.密闭容器中气体总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
③根据表中数据,计算25℃时氨基甲酸铵的分解平衡常数为1.64×10-8(mol/L)3(保留两位小数).
(4)25℃时,NH3•H2O电离常数K=1.8×10-5,Mg(OH)2的溶度积常数Ksp=1.8×10-11,在某MgC12溶液中加入一定量的某浓度的氨水后,测得混合液pH=11,计算此温度下残留在溶液中的c(Mg2+)=1.8×10-5mol/L.
 钛(Ti)被称为继铁、铝之后的第三金属.
钛(Ti)被称为继铁、铝之后的第三金属.