题目内容
5.向H2SO4溶液中加入BaCl2溶液,直到反应恰好完全为止.结果反应后溶液的质量恰好等于原BaCl2溶液的质量,则该H2SO4溶液中溶质的质量分数为( )| A. | 50% | B. | 48.8% | C. | 42.1% | D. | 72.3% |
分析 生成溶液的质量=氯化钡溶液的质量+硫酸溶液的质量-硫酸钡的质量,根据题意:生成溶液的质量恰好等于原BaCl2溶液的质量,由此可知:硫酸溶液的质量=硫酸钡的质量;依据硫酸与氯化钡反应的化学方程式,假设原硫酸溶液的质量,由反应中硫酸与硫酸钡的质量关系,求出硫酸溶液中溶质的质量,再由溶液中溶质质量分数计算式求出硫酸溶液中溶质质量分数.
解答 解:硫酸溶液的质量=硫酸钡的质量,设硫酸钡的质量为233g,则硫酸溶液的质量为233g,再设硫酸溶液中溶质的质量是x
BaCl2+H2SO4═BaSO4↓+2HCl
98 233
x 233g
$\frac{98}{x}=\frac{233}{233g}$
解之得:x=98g;
所以滴入的硫酸溶液中溶质的质量分数是$\frac{98g}{233g}$×100%=42.1%,
故选C.
点评 解答无数据计算题时,可以根据题意先分析所发生的化学反应,再找出物质间的质量关系,大胆假设,假设物质的质量时,与物质的相对分子质量相同可以将计算简化,解答起来更容易.

练习册系列答案
相关题目
15.下列关系不正确的是( )
| A. | 原子半径:C>Si | B. | 热稳定性:HF>HBr | C. | 还原性:S2->C1- | D. | 酸性:HNO3>H3PO4 |
16.下列物质依次按照混合物、氧化物、弱电解质和非电解质的顺序排列的一组是( )
| A. | 淀粉、CuO、HClO、Cu | |
| B. | 水玻璃、Na2O•CaO•6SiO2、Na2O、SO3 | |
| C. | KAl(SO4)2•12H2O、KClO3、NH3•H2O、CH3CH2OH | |
| D. | 普通玻璃、H2O、CH3COOH、葡萄糖 |
13.在标准状况下,由CO、甲烷和丁烷组成的混合气体11.2L完全燃烧后,生成相同状况下的CO2气体17.92L.则原混合烃中,CO、甲烷和丁烷的体积比不可能为( )
| A. | 3:1:1 | B. | 2:2:1 | C. | 3:4:3 | D. | 7:13:5 |
10.化学与人类生活密切相关,下列说法错误的是( )
| A. | 苯酚有一定毒性,可以作消毒剂和防腐剂 | |
| B. | 油脂皂化生成的高级脂肪酸钠是肥皂的有效成分 | |
| C. | 用食醋去除水壶中的水垢时所发生的是水解反应 | |
| D. | 木糖醇是一种新型的甜味剂,适合糖尿病患者的需要 |
17.下列相关实验的操作或结论正确的是( )
| A. | 将某气体通入溴水中,溴水颜色褪去,该气体一定是乙烯 | |
| B. | 制硝基苯时温度计水银球在反应液中 | |
| C. | 用酸性高锰酸钾溶液既可鉴别CH4和C2H4,又可除去CH4中的C2H4 | |
| D. | 在提纯鸡蛋中的蛋白质时,可向鸡蛋清溶液中加入浓(NH4)2SO4溶液,然后将所得沉淀滤出,即得较纯的蛋白质 |
14.元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是
a.原子半径和离子半径均减小b.金属性减弱,非金属性增强
c.氧化物对应的水化物碱性减弱,酸性增强d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为氩,氧化性最弱的简单阳离子是Na+
(3)已知:
工业制镁时,电解MgCl2而不电解MgO的原因是MgO的熔点高,熔融时消耗更多能量,增加生产成本
制铝时,电解Al2O3而不电解AlCl3的原因是氯化铝是共价化合物,熔融态氯化铝难导电
(4)晶体硅(熔点1410℃)是良好的半导体材料.由粗硅制纯硅过程如下:Si(粗)$→_{460℃}^{Cl_{2}}$SiCl4$\stackrel{蒸馏}{→}$SiCl4(纯)$→_{1100℃}^{H_{2}}$Si(纯)
写出SiCl4的电子式: ;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:SiCl4(g)+2H2(g)$\frac{\underline{\;1100℃\;}}{\;}$Si(s)+4HCl(g)△H=+0.025akJ•mol-1
;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:SiCl4(g)+2H2(g)$\frac{\underline{\;1100℃\;}}{\;}$Si(s)+4HCl(g)△H=+0.025akJ•mol-1
(5)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是b
a.NH3 b.HI c.SO2 d.CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1.写出该反应的化学方程式:4KClO3$\frac{\underline{\;400℃\;}}{\;}$KCl+3KClO4
(7)工业上,通过如下转化可制得KClO3晶体:NaCl溶液$→_{Ⅰ}^{80℃}$NaClO3溶液$→_{Ⅱ}^{温室,KCl}$KClO3晶体,完成Ⅰ中反应的总化学方程式:NaCl+3H2O═NaClO3+3H2↑□NaCl+□H2O═□NaClO3+□
Ⅱ该反应过程能析出KClO3晶体而无其他晶体析出的原因是相同温度下,溶解度小的物质先析出.
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是
a.原子半径和离子半径均减小b.金属性减弱,非金属性增强
c.氧化物对应的水化物碱性减弱,酸性增强d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为氩,氧化性最弱的简单阳离子是Na+
(3)已知:
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
制铝时,电解Al2O3而不电解AlCl3的原因是氯化铝是共价化合物,熔融态氯化铝难导电
(4)晶体硅(熔点1410℃)是良好的半导体材料.由粗硅制纯硅过程如下:Si(粗)$→_{460℃}^{Cl_{2}}$SiCl4$\stackrel{蒸馏}{→}$SiCl4(纯)$→_{1100℃}^{H_{2}}$Si(纯)
写出SiCl4的电子式:
 ;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:SiCl4(g)+2H2(g)$\frac{\underline{\;1100℃\;}}{\;}$Si(s)+4HCl(g)△H=+0.025akJ•mol-1
;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:SiCl4(g)+2H2(g)$\frac{\underline{\;1100℃\;}}{\;}$Si(s)+4HCl(g)△H=+0.025akJ•mol-1(5)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是b
a.NH3 b.HI c.SO2 d.CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1.写出该反应的化学方程式:4KClO3$\frac{\underline{\;400℃\;}}{\;}$KCl+3KClO4
(7)工业上,通过如下转化可制得KClO3晶体:NaCl溶液$→_{Ⅰ}^{80℃}$NaClO3溶液$→_{Ⅱ}^{温室,KCl}$KClO3晶体,完成Ⅰ中反应的总化学方程式:NaCl+3H2O═NaClO3+3H2↑□NaCl+□H2O═□NaClO3+□
Ⅱ该反应过程能析出KClO3晶体而无其他晶体析出的原因是相同温度下,溶解度小的物质先析出.
9.下列说法正确是( )
| A. | 苯与苯酚都能与溴水发生取代反应 | |
| B. | 苯酚与苯甲醇(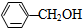 )组成相差一个-CH2-原子团,因而它们互为同系物 )组成相差一个-CH2-原子团,因而它们互为同系物 | |
| C. | 在苯酚溶液中,滴入几滴FeCl3溶液,溶液立即呈紫色 | |
| D. | 苯酚分子中由于羟基对苯环的影响,使苯环上5个氢原子都容易取代 |