题目内容
18.现用质量分数为98%、密度为1.84g•cm3的浓H2SO4配制500mL、0.2mol•L-1的稀H2SO4.可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④药匙 ⑤量筒 ⑥容量瓶 ⑦托盘天平.请回答下列问题:
(1)上述仪器中,在配制稀H2SO4时用不到的有②④⑦(填代号).配制时还欠缺的仪器是胶头滴管.
(2)经计算,需浓H2SO4的体积为5.4mLmL(精确到0.1).
(3)配制过程有以下操作:
A.移液 B.量取 C.洗涤 D.定容 E.溶解 F.摇匀
其正确的操作顺序应是BEACADF(填序号).
(4)在配制过程中,其他操作都准确,下列操作中,能引起误差偏高的有①②⑤(填代号)
①洗涤量取浓H2SO4后的量筒,并将洗涤液转移到容量瓶中
②稀释后的H2SO4溶液未等冷却至室温就转移到容量瓶中
③定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
④转移前,容量瓶中含有少量蒸馏水
⑤定容时,俯视标线
(5)从上述容量瓶中移取25.00mL的稀硫酸溶液与100mL的容量瓶,加水稀释至刻度线.请问所得溶液中c(H+)=0.1mol/L.
分析 (1)根据配制500mL、0.2mol•L-1的稀H2SO4的步骤选择使用的仪器,然后判断不需要的仪器;
(2)根据c=×$\frac{1000ρw}{M}$计算出浓硫酸的物质的量浓度,然后根据溶液稀释过程中溶质的物质的量不变计算出浓硫酸的体积;
(3)根据溶液配制,一般可分为以下步骤:计算、称量、溶解或稀释、冷却、转移、洗涤、定容、摇匀据此进行排序;
(4)根据c=$\frac{n}{V}$可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量n和溶液的体积V引起的,误差分析时,关键要看配制过程中引起n和V怎样的变化:若n比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若n比理论值大,或V比理论值小时,都会使所配溶液浓度偏大;
(5)稀释前后氢离子物质的量保持不变.
解答 解:(1)配制500mL、0.2mol•L-1的稀H2SO4的步骤为:计算、量取、稀释、冷却、转移、洗涤、定容、摇匀等,需要选用的仪器为:量筒、烧杯、玻璃棒、容量瓶、胶头滴管、500mL容量瓶等,不需要的仪器为:②烧瓶、④药匙、⑦托盘天平,还欠缺的仪器是胶头滴管,
故答案为:②④⑦;胶头滴管;
(2)该浓硫酸的物质的量浓度为:$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,配制500mL、0.2mol•L-1的稀H2SO4,需要浓硫酸的体积为:$\frac{0.2mol/L×0.5L}{18.4mol/L}$≈0.0054L=5.4mL,
故答案为:5.4mL;
(3)稀硫酸配制,一般可分为以下步骤:计算、称量、稀释、冷却、转移、洗涤、定容、摇匀,所以其操作顺序是BEACADF,
故答案为:BEACADF;
(4)①量取浓硫酸的量筒不能洗涤,如果洗涤量取浓H2SO4后的量筒,并将洗涤液转移到容量瓶中,会导致量取的浓硫酸体积偏大,配制的溶液浓度偏高;
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中,热的溶液体积判断,冷却后溶液体积变小,配制的溶液浓度偏高;
③定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线,导致配制的溶液体积偏大,配制的溶液浓度偏低;
④转移前,容量瓶中含有少量蒸馏水,对溶质的物质的量及溶液体积没有影响,不影响配制结果;
⑤定容时,俯视标线,导致加入的蒸馏水体积偏小,配制的溶液浓度偏高,
故答案为:①②⑤;
(5)0.2mol/L×0.025L×2=c(H+)×0.1L,解得c(H+)=0.1mol/L,
故答案为:0.1mol/L.
点评 本题考查了配制一定物质的量浓度的溶液的方法,该题是中等难度的试题,试题基础性强,该题难易适中,注重灵活性,侧重对学生能力的培养和解题方法的指导和训练,有利于培养学生的逻辑思维能力和严谨的规范实验操作能力;该题的难点在于误差分析,注意明确误差分析的方法.

| A. | NaOH | B. | HCl | C. | CaCO3(固体) | D. | H2O |
| A. | NaOH | B. | NaCl | C. | HCl | D. | Ca(ClO)2 |
 用中和滴定法测定某烧碱样品的纯度.有以下步骤:
用中和滴定法测定某烧碱样品的纯度.有以下步骤:(1)配制待测液:用已称好的5.0g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制1000mL溶液.除烧杯和玻璃棒外,还需要用到的主要仪器有1000mL容量瓶、胶头滴管.
(2)滴定:
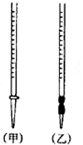
①盛装0.1000mol•L-1的盐酸标准液应该使用甲(选填“甲”或“乙”).
②将一定体积的待测溶液装在锥形瓶内,若采用甲基橙做指示剂,当观察到由橙色变为黄色,且半分钟内不变色时,滴定达到终点.
(3)误差讨论:(选填“偏高”、“偏低”或“无影响”)
①用蒸馏水冲洗锥形瓶后未烘干,测定结果无影响;
②在滴定过程中不慎将数滴酸液滴在锥形瓶外,测定结果偏高;
③读数时,滴定前仰视,滴定后俯视,测定结果偏低.
(4)有关数据记录如下:
| 测定序号 | 待测溶液的体积(mL) | 所耗盐酸标准液的体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 1 | 20.00 | 0.50 | 20.78 |
| 2 | 20.00 | 1.20 | 21.32 |
| 3 | 20.00 | 0.40 | 21.20 |
| A. | ${\;}_{x}^{y}$R | B. | ${\;}_{z}^{y+x}$R | C. | ${\;}_{x+z}^{y}$R | D. | ${\;}_{x+z}^{y+x+z}$R |
 制取氢氧化铁胶体
制取氢氧化铁胶体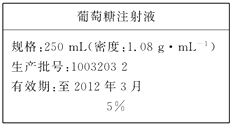 为维持人体血液中的血糖含量,在给病人输液时,通常用葡萄糖注射液,下页图是医院给病人输液时使用的一瓶质量分数为5%的葡萄糖(C6H12O6)注射液的标签.某学生欲在实验室中配制500mL该葡萄糖注射液.
为维持人体血液中的血糖含量,在给病人输液时,通常用葡萄糖注射液,下页图是医院给病人输液时使用的一瓶质量分数为5%的葡萄糖(C6H12O6)注射液的标签.某学生欲在实验室中配制500mL该葡萄糖注射液.