题目内容
12.25℃时,在l0mL浓度均为0.1mol.L-1的HC1和CH3COOH混合溶液中滴加0.1mol.L -1NaOH,下列有关溶液中粒子浓度关系正确的是( )| A. | 未加NaOH时:c(H+)>c(Cl-)=c(CH3COOH) | |
| B. | 加入l0mLNaOH时:c(OH-)+c(CH3COO-)=c(H+) | |
| C. | 加入NaOH至溶液Ph=7时:c(Cl一)-c(Na+) | |
| D. | 加入20mL NaOH时:c(Na+)=c(Cl-)+c(CH3COO一') |
分析 A、未加NaOH时,浓度均为0.1mol.L-1的HC1和CH3COOH混合溶液中,盐酸完全电离,醋酸部分电离;
B、加入l0mLNaOH时,酸全部反应,得到氯化钠和醋酸钠的混合物,根据溶液中的质子守恒来回答;
C、加入NaOH至溶液PH=7时,根据溶液中的电荷守恒来回答;
D、加入20mLNaOH时,得到的是等浓度的氯化钠、醋酸钠和氢氧化钠的混合物,根据电荷守恒来回答.
解答 解:A、未加NaOH时,浓度均为0.1mol.L-1的HC1和CH3COOH混合溶液中,盐酸完全电离,醋酸部分电离,c(H+)>c(Cl-)>c(CH3COOH),故A错误;
B、加入l0mLNaOH时,酸全部反应,得到等浓度的氯化钠和醋酸钠的混合物,氯化钠中钠离子和氯离子浓度相等,溶液中存在质子守恒c(OH-)+c(CH3COO-)=c(H+),故B正确;
C、加入NaOH至溶液PH=7时,c(OH-)=c(H+),根据溶液中的电荷守恒:c(Cl-)+c(OH-)+c(CH3COO-)=c(H+)+c(Na+),得到c(Cl-)+c(CH3COO-)=c(Na+),故C错误;
D、加入20mLNaOH时,得到的是等浓度的氯化钠、醋酸钠和氢氧化钠的混合物,根据电荷守恒:c(Cl-)+c(OH-)+c(CH3COO-)=c(H+)+c(Na+),溶液显示碱性,c(OH-)>c(H+),故c(Na+)>c(Cl-)+c(CH3COO-),故D错误.
故选B.
点评 本题考查了酸碱混合的定性判断及溶液中离子浓度定性比较,题目难度中等,注意掌握酸碱混合后溶液酸碱性的判断方法,明确电荷守恒、物料守恒的含义,能够根据溶液中守恒关系判断各离子浓度大小.

练习册系列答案
相关题目
7.在一个恒温、恒容密闭容器中,有两个可左右自由滑动的密封隔板(a、b),将容器分成三部分,已知充入的三种气体质量相等,当隔板静止时,容器内气体所占体积如图所示( 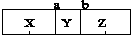 ),下列说法中错误的是( )
),下列说法中错误的是( )
 ),下列说法中错误的是( )
),下列说法中错误的是( )| A. | 若Y是C4H8,则X可能是N2 | B. | 分子数目:X=Z=2Y | ||
| C. | 若X是O2,则Z不可能是CO2 | D. | 气体密度:X=Z=2Y |
5.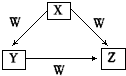 X、Y、Z、W四种物质之间有如图所示的转化关系(部分物质未写全),则X、Y、Z、W可能是( )
X、Y、Z、W四种物质之间有如图所示的转化关系(部分物质未写全),则X、Y、Z、W可能是( )
①C、CO ②AlCl2、Al(OH)3 ③Na2CO3、NaHCO3.
 X、Y、Z、W四种物质之间有如图所示的转化关系(部分物质未写全),则X、Y、Z、W可能是( )
X、Y、Z、W四种物质之间有如图所示的转化关系(部分物质未写全),则X、Y、Z、W可能是( )①C、CO ②AlCl2、Al(OH)3 ③Na2CO3、NaHCO3.
| A. | ①②③ | B. | ①② | C. | ② | D. | ① |
17.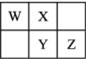 W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知( )
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知( )
 W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知( )
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知( )| A. | Y元素氧化物对应水化物的酸性一定弱于Z | |
| B. | W、X、Y中最简单氢化物稳定性最强的是X | |
| C. | X元素形成的单核阴离子还原性大于Y | |
| D. | Z元素单质在化学反应中只表现氧化性 |
4.常温下,下列事实能说明亚硝酸是弱电解质的是( )
| A. | NaNO2溶液的pH大于7 | B. | 用HNO2溶液作导电试验,灯泡很暗 | ||
| C. | HNO2不跟NaCl反应 | D. | 可以使石蕊试剂变色 |
1.下列叙述中正确的是( )
| A. | 中和10ml 0.1 mol•L-1醋酸与中和100ml 0.01 mol•L-1醋酸所需同种碱溶液的量不同 | |
| B. | 体积相等、pH相等盐酸和硫酸溶液中,H+离子的物质的量相等 | |
| C. | 等体积pH=3的酸溶液与pH=11的碱溶液相混合后,混合溶液的pH一定等于7 | |
| D. | 250C时,将0.1 mol•L-1NaOH溶液与pH=1的稀硫酸等体积混合,混合后溶液pH=7 |
2.A、B、C、D、E五种短周期元素,其原子序数逐渐增大.元素A的单质是密度最小的气体,元素B的单质存在两种以上同素异形体,且其中一种是自然界中硬度最大的单质,元素D的最外层电子数是次外层电子数的三倍.B、C、D、E四种元素均能与A形成电子数相等的四种分子,且化合物中各原子的个数比如下表:
下列说法正确的是( )
| 化合物 | 甲 | 乙 | 丙 | 丁 |
| 原子个数比 | B:A=1:3 | C:A=1:2 | D:A=1:1 | E:A=1:1 |
| A. | 元素E在元素周期表中的位置为第二周期第ⅦA族 | |
| B. | 原子半径:A<B<C<D | |
| C. | A、C、E中三种元素或任意两种元素形成的物质中只可能含有共价键 | |
| D. | A、B、C、D四元素中的三种能形成多种与甲分子电子数相等的化合物 |
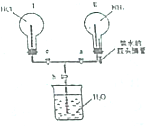 某实验小组在实验室中制取氨气并设计实验验证氨气的某些性质.
某实验小组在实验室中制取氨气并设计实验验证氨气的某些性质. 向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题:
向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题: