题目内容
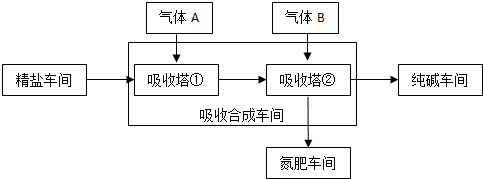
15.“索尔维制碱法”工艺流程如图所示,请回答下列问题: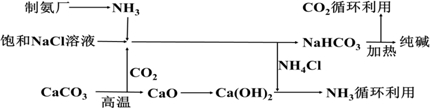
(1)合成氨工业生产中所用的α-Fe催化剂的主要成分是FeO和Fe2O3,若某α-Fe催化剂中FeO和Fe2O3的物质的量相等,则其中Fe2+与Fe3+的物质的量之比为1:2;
(2)向饱和NaCl溶液中先通入NH3气体,效果更好.反应制得NaHCO3沉淀和NH4Cl溶液的化学程式为NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
(3)索尔维制碱法除了得到纯碱外,还会产生一种废渣CaCl2.侯氏制碱法在此工业上改进,不再使用CaCO3制备CO2,而是在制备NH3的过程中制得CO2,则侯氏制碱法在得到纯碱的同时还制得了NH4Cl,此物质在农业上的用途是作氮肥.
分析 (1)根据某α-Fe催化剂中FeO和Fe2O3的物质的量相等,计算其中Fe2+与Fe3+的物质的量之比;
(2)为了增大二氧化碳的溶解性,所以向饱和NaCl溶液中先通入NH3,后通入CO2,效果更好,氯化钠、二氧化碳、氨气和水反应生成NaHCO3沉淀和NH4Cl;
(3)根据索尔维制碱法的流程使用CaCO3制备CO2,最后用氢氧化钙与氯化铵反应生成氨气循环,同时生成氯化钙废渣;而侯氏制碱法在得到纯碱的同时还制得了NH4Cl,可以作氮肥.
解答 解:(1)某α-Fe催化剂中FeO和Fe2O3的物质的量相等,则其中Fe2+与Fe3+的物质的量之比1:2,故答案为:1:2;
(2)为了增大二氧化碳的溶解性,所以向饱和NaCl溶液中先通入NH3,后通入CO2,效果更好,发生反应的方程式为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl,故答案为:NH3; NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl;
(3)根据索尔维制碱法的流程使用CaCO3制备CO2,最后用氢氧化钙与氯化铵反应生成氨气循环,同时生成氯化钙废渣;而侯氏制碱法不再使用CaCO3制备CO2,在得到纯碱的同时还制得了NH4Cl,所以物质在农业上的用途是可以作氮肥,故答案为:CaCl2;NH4Cl;作氮肥.
点评 本题考查了纯碱工业制备原理分析比较,反应实质的应用,试剂的作用,理解生产原理和过程的实质是解答的关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.下列叙述正确的是( )
| A. | NaCl的摩尔质量是58.5g | |
| B. | 32g氧气中含有2mol氧 | |
| C. | 58.5gNaCl中含有l mol NaCl分子 | |
| D. | 0.l mol二氧化碳含有6.02×1022个CO2分子 |
9.下列说法正确的是( )
| A. | NaCl溶液在电流作用下电离成Na+ 和Cl- | |
| B. | 蔗糖在水溶液里或熔融状态时均不导电,所以它不是电解质 | |
| C. | 强电解质溶液的导电能力一定比弱电解质溶液的导电能力强 | |
| D. | 纯水的导电性很差,所以水不是电解质 |
20.在体积一定的密闭容器中给定物质A、B、C的量,在一定条件下发生反应建立的化学平衡:aA(g)+bB(g)?xC(g),符合图1所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强).在图2中,Y轴是指:( )
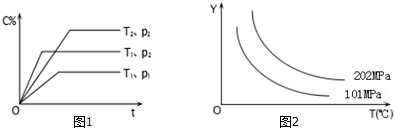

| A. | 反应物A的转化率 | B. | 平衡混合气中物质B的质量分数 | ||
| C. | 平衡混合气的密度 | D. | 平衡混合气中C的体积分数 |
7.工业上用化学法除锅炉的水垢时,先向锅炉中注入饱和Na2CO3溶液侵泡,将水垢中的CaSO4转化为CaCO3,再用盐酸除去[Ksp(CaCO3)=1×10-10,Ksp(Ca SO4)=1×10-6].下列说法正确的是( )
| A. | 温度升高,Na2CO3溶液中各种离子的浓度均增大 | |
| B. | 沉淀转化的离子方程式为CO32-(aq)+CaSO4(s)?CaCO3(s)+SO42-(aq) | |
| C. | 该条件下CaCO3的溶解度约为1×10-3g | |
| D. | CaCO3和CaSO4共存的体系中,一定有$\frac{c(S{O}_{4}^{2-})}{c(C{O}_{3}^{2-})}$=9×104 |
4.已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1
现有温度、容积相同的4个密闭容器,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如表:
则下列说法中正确的是ACD.
A.2c2<c3 2y>z B. p1=p2 x=y
C.(a1+a3)<1 D.若x=24.5kJ,则w=14.7kJ.
现有温度、容积相同的4个密闭容器,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如表:
| 容器 | 1 | 2 | 3 | 4 |
| 反应物投入量 (始态) | 1mol CO2 3mol H2 | 1mol CH3OH 1mol H2O | 2mol CH3OH 2mol H2O | 0.8mol CO2 2.4mol H2 0.2mol CH3OH 0.2mol H2O |
| CH3OH的平衡浓度/mol•L-1 | c1 | c2 | c3 | c4 |
| 反应的能量变化 | 放出 x kJ | 吸收y kJ | 吸收z kJ | 放出 w kJ |
| 体系压强/Pa | p1 | p2 | p3 | p4 |
| 反应物转化率 | a1 | a2 | a3 | a4 |
A.2c2<c3 2y>z B. p1=p2 x=y
C.(a1+a3)<1 D.若x=24.5kJ,则w=14.7kJ.
5.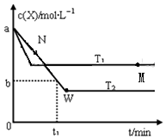 在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示,下列叙述正确的是( )
在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示,下列叙述正确的是( )
 在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示,下列叙述正确的是( )
在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示,下列叙述正确的是( )| A. | M点时再加入一定量的X,平衡后X的转化率增大 | |
| B. | T2下,在0~t1时间内,v(Y)=$\frac{a-b}{{t}_{1}}$mol/(L•min) | |
| C. | M点的正反应速率v正小于N点的逆反应速率v逆 | |
| D. | 该反应进行到M点吸收的热量小于进行到W点放出的热量 |