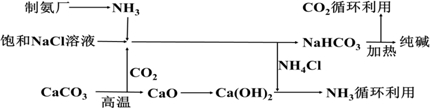
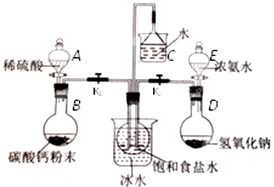
题目内容
4.已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1现有温度、容积相同的4个密闭容器,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如表:
| 容器 | 1 | 2 | 3 | 4 |
| 反应物投入量 (始态) | 1mol CO2 3mol H2 | 1mol CH3OH 1mol H2O | 2mol CH3OH 2mol H2O | 0.8mol CO2 2.4mol H2 0.2mol CH3OH 0.2mol H2O |
| CH3OH的平衡浓度/mol•L-1 | c1 | c2 | c3 | c4 |
| 反应的能量变化 | 放出 x kJ | 吸收y kJ | 吸收z kJ | 放出 w kJ |
| 体系压强/Pa | p1 | p2 | p3 | p4 |
| 反应物转化率 | a1 | a2 | a3 | a4 |
A.2c2<c3 2y>z B. p1=p2 x=y
C.(a1+a3)<1 D.若x=24.5kJ,则w=14.7kJ.
分析 1容器反应物投入1mol CO2、3mol H2,2容器反应物投入量1mol CH3OH、1mol H2O,4容器反应物的投入量0.8mol CO2、2.4mol H2、0.2mol CH3OH、0.2mol H2O,恒温恒容,则1容器、2容器与4容器是等效平衡;
2容器反应物投入量1mol CH3OH、1mol H2O,3容器反应物投入量2mol CH3OH、2mol H2O,是2中的二倍,可以看作在恒温且容积是2容器两倍条件下,到达平衡后,再压缩体积为与2容器体积相等所到达的平衡;据此分析平衡移动.
解答 解:1容器反应物投入1mol CO2、3mol H2,2容器反应物投入量1mol CH3OH、1mol H2O,4容器反应物的投入量0.8mol CO2、2.4mol H2、0.2mol CH3OH、0.2mol H2O,恒温恒容,则1容器、2容器与4容器是等效平衡,则各组分的物质的量、含量、转化率等完全相等,
2容器反应物投入量1mol CH3OH、1mol H2O,3容器反应物投入量2mol CH3OH、2mol H2O,是2中的二倍,可以看作在恒温且容积是2容器两倍条件下,到达平衡后,再压缩体积为与2容器体积相等所到达的平衡,由于该反应是体积减小的反应,缩小容器体积,增大了压强,平衡向着正向移动,
A、2、3的反应为CH3OH(g)+H2O(g)?CO2(g)+3H2(g)△H=+49.0kJ•mol-1,3是2投入量的两倍,若平衡不移动,2c2=c3,2y=z,恒温、恒容,则3是对2平衡状态两倍的基础上增大压强,对该反应,增大压强,平衡逆向移动,则3平衡时CH3OH的平衡浓度大于2的两倍,2c2<c3;该反应吸热反应,2/3是从逆反应开始,吸收热量,3的对于2的平衡向着放热方向移动,则2y>z,A正确;
B、1、2换算为同种物质表示,投入量相等,属于等效平衡,则平衡时的状态一样:即各物质的浓度相等,p1=p2;根据盖斯定律可知,1与2的反应的能量变化之和为49.0kJ,故x+y=49.0,B错误;
C、3反应物投入量2mol CH3OH、2mol H2O,是2的二倍,若平衡不移动,转化率α1+α3=1,由于3中相当于增大压强,平衡向着正向移动,反应物的转化率减小,所以转化率α1+α3<1,C正确;
D、设1中反应CO2a mol,则平衡时为CO2(1-a),放出的热量x=49a,由题x=24.5,则a=$\frac{24.5}{49}$;4中0.8mol CO2、2.4mol H2、0.2mol CH3OH、0.2mol H2O用极限转移法与1属于等效平衡,则平衡状态一样,CO2也为(1-a),参与反应的 CO2也为0.8-(1-a)=a-0.2,放出的热量w=(a-0.2)×49,带入a的值,解得w=14.7,D正确.
故答案为:ACD.
点评 本题考查化学平衡影响因素、等效平衡、化学平衡的计算,题目计算量较大,题目难度较大,关键是构建平衡建立的等效途径,试题侧重对学生灵活运用基础知识解决实际问题的能力的培养.

 考前必练系列答案
考前必练系列答案(1)已知:①4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=-1266.8kJ•mol-1
②N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1
写出氨高温催化氧化的热化学方程式4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-905.8kJ•mol-1.
(2)氨气、空气可以构成燃料电池,则原电解质溶液显碱性(填“酸性”、“中性”或“碱性”),
负极的电极反应式为2NH3+6OH--6e-═N2+6H2O.
(3)在0.5L的密闭容器中,一定量的N2和H2发生反应:N2(g)+3H2(g)?2NH3(g)△H=akJ/mol,其化学平衡常数K与温度的关系如下:
| 温度/oC | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
②理论上,为了增大平衡时H2的转化率,可采取的措施是ad(填字母序号).
a.增大压强 b.使用合适的催化剂
c.升高温度 d.及时分离出产物中的NH3
③400oC时,测得某时刻氨气、氮气、氢气的物质的量分别为3mol、2mol、1mol,此时刻该反应的v正(N2)<v逆(N2)(填“>”、“<”或“=”).
(4)25oC时,将amol•L-1的氨水与0.1mol•L-1的盐酸等体积混合
①当溶液中离子浓度关系满足c(NH4+)>c(Cl-)时,反应的情况可能为a(填字母序号).
a.盐酸不足,氨水剩余 b.氨水与盐酸恰好完全反应 c.盐酸过量
②当溶液中c(NH4+)=c(Cl-)时,用含a的代数式表示NH3•H2O的电离常数Kb=$\frac{1{0}^{-8}}{a-0.1}$.
 铁及其化合物在工农业生产、科学研究等方面具有广泛用途.回答下列问题:
铁及其化合物在工农业生产、科学研究等方面具有广泛用途.回答下列问题:(1)在FeCl3饱和溶液中滴加饱和纯碱溶液可观察到有红褐色沉淀和气泡生成,写出该反应的离子方程式:2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑.
(2)工业上应用铁矿石冶炼金属铁时涉及的反应有:
Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H1=-24.8kJ•mol-1
3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H2=-47.2kJ•mol-1
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H3=+640.5kJ•mol-1
写出CO还原FeO的热化学方程式:CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-218.0kJ/mol.
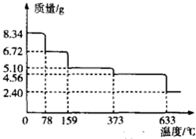
(3)绿矾(FeSO4•7H2O)在受热条件下不稳定,易发生分解.现取绿矾样品8.34g,在隔绝空气的条件下加热,样品质量随着温度的变化曲线如图所示.
159℃时的固体物质的化学式为FeSO4•H2O;633℃时分解除生成固体物质外,还有两种气体物质,且这两种气体物质的密度之比为4:5,则633℃时分解的化学方程式为2FeSO4$\frac{\underline{\;633℃\;}}{\;}$Fe2O3+SO2↑+SO3↑.
(4)已知密闭容器中发生反应:Fe(S)+CO2(g)?FeO(s)+CO(g)△H>0.测得在不同温度下,该反应的平衡常数随温度的变化数据如表所示.
| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | x | Y |
a.1.47、2.40 b.2.40、1.47 c.0.64、0.48d.0.48、0.64
②500℃时,在容积为2L的密闭容器中放入2mol铁粉和2mol CO2,若测得10min时反应达到平衡状态,则0~10min内的平均反应速率v(CO2)=0.05mol/(L•min).
③800℃时,在反应达到平衡状态后,要使反应速率减小且平衡逆向移动,可采取的措施有减小二氧化碳的物质的量(或者降低温度)(写出一种即可).
(5)高铁酸钠(Na2FeO4)能有效地杀灭水中的病菌和病毒,在对水的消毒和净化过程中,不产生任何对人体有害的物质,其消毒和除污效果比含氯消毒剂要好.高铁酸钠的制备方法之一是电解:Fe+2H2O+2OH-$\frac{\underline{\;通电\;}}{\;}$FeO42-+3H2↑,电解质溶液选用NaOH溶液.该电解池的阳极反应式为Fe+8OH--6e-=FeO42-+4H2O.
| A. | N2(g)+3H2(g)?2NH3(g),恒容条件下达到平衡后充入He,N2的转化率与时间的关系 | |
| B. | CH4(g)+H2O(g)?CO(g)+3H2(g);△H>0,平衡后CH4的物质的量与△H的关系 | |
| C. | FeCl3+3KSCN?Fe(SCN)3+3KCl,平衡后加入KCl固体,c(Cl-)与正反应速率关系 | |
| D. | H2(g)+I2(g)?2HI(g),平衡后缩小容器容积,速率与时间的关系 |

| A. | M中达到平衡后再通入一定量的氦气,平衡不移动,容器内气体的密度不变 | |
| B. | 若x:y=1:2,则平衡时,M中的转化率:A>B | |
| C. | 若x:y=1:3,当M中放出热量172.8 kJ时,A的转化率为90% | |
| D. | N中达到平衡后再通入一定量的氦气时,v(正)<v(逆) |