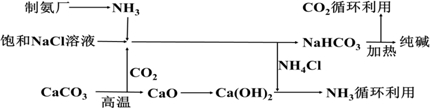
题目内容
7.工业上用化学法除锅炉的水垢时,先向锅炉中注入饱和Na2CO3溶液侵泡,将水垢中的CaSO4转化为CaCO3,再用盐酸除去[Ksp(CaCO3)=1×10-10,Ksp(Ca SO4)=1×10-6].下列说法正确的是( )| A. | 温度升高,Na2CO3溶液中各种离子的浓度均增大 | |
| B. | 沉淀转化的离子方程式为CO32-(aq)+CaSO4(s)?CaCO3(s)+SO42-(aq) | |
| C. | 该条件下CaCO3的溶解度约为1×10-3g | |
| D. | CaCO3和CaSO4共存的体系中,一定有$\frac{c(S{O}_{4}^{2-})}{c(C{O}_{3}^{2-})}$=9×104 |
分析 A.升高温度,促进水解,碱性增强;
B.由Ksp可知,CaCO3更难溶;
C.结合c(CO32-)=c(Ca2+)=$\sqrt{Ksp}$计算;
D.CaCO3和CaSO4共存的体系中,$\frac{c(S{O}_{4}^{2-})}{c(C{O}_{3}^{2-})}$=$\frac{\sqrt{Ksp(CaS{O}_{4})}}{\sqrt{Ksp(CaC{O}_{3})}}$.
解答 解:A.升高温度,促进水解,碱性增强,Na2CO3溶液中钠离子浓度不变,氢离子浓度减小,其它离子浓度增大,故A错误;
B.由Ksp可知,CaCO3更难溶,沉淀转化的离子方程式为CO32-(aq)+CaSO4(s)?CaCO3(s)+SO42-(aq),故B正确;
C.由c(CO32-)=c(Ca2+)=$\sqrt{Ksp}$=$\sqrt{1×1{0}^{-10}}$=10-5mol/L,设溶液为1L,则$\frac{S}{100}$=$\frac{1{0}^{-5}mol×100g/mol}{1000g}$,解得S=10-4g,该条件下CaCO3的溶解度约为1×10-4g,故C错误;
D.CaCO3和CaSO4共存的体系中,$\frac{c(S{O}_{4}^{2-})}{c(C{O}_{3}^{2-})}$=$\frac{\sqrt{Ksp(CaS{O}_{4})}}{\sqrt{Ksp(CaC{O}_{3})}}$=$\frac{1×1{0}^{-6}}{1×1{0}^{-10}}$=104,故D错误;
故选B.
点评 本题考查难溶电解质的溶解平衡,为高频考点,把握溶解平衡移动、Ksp的计算、沉淀转化为解答的关键,侧重分析与应用能力的考查,注意选项C中溶解度的计算为解答的难点,题目难度不大.

 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案| A. | 石墨棒 | B. | 固体氧化钾 | C. | 盐酸 | D. | 熔融氢氧化钠 |
| A. | 1:3 | B. | 1:5 | C. | 5:1 | D. | 3:1 |

| A. | 在t℃时,AgBr的Ksp为4.9×10-13 | |
| B. | 在t℃时,AgCl(s)+Br-(aq)═AgBr(s)+Cl-(aq)的平衡常数 K≈816 | |
| C. | 图中a点对应的是AgBr的不饱和溶液 | |
| D. | 在AgBr饱和溶液中加入NaBr固体,可使溶液由c点变到b点 |
(1)已知:①4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=-1266.8kJ•mol-1
②N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1
写出氨高温催化氧化的热化学方程式4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-905.8kJ•mol-1.
(2)氨气、空气可以构成燃料电池,则原电解质溶液显碱性(填“酸性”、“中性”或“碱性”),
负极的电极反应式为2NH3+6OH--6e-═N2+6H2O.
(3)在0.5L的密闭容器中,一定量的N2和H2发生反应:N2(g)+3H2(g)?2NH3(g)△H=akJ/mol,其化学平衡常数K与温度的关系如下:
| 温度/oC | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
②理论上,为了增大平衡时H2的转化率,可采取的措施是ad(填字母序号).
a.增大压强 b.使用合适的催化剂
c.升高温度 d.及时分离出产物中的NH3
③400oC时,测得某时刻氨气、氮气、氢气的物质的量分别为3mol、2mol、1mol,此时刻该反应的v正(N2)<v逆(N2)(填“>”、“<”或“=”).
(4)25oC时,将amol•L-1的氨水与0.1mol•L-1的盐酸等体积混合
①当溶液中离子浓度关系满足c(NH4+)>c(Cl-)时,反应的情况可能为a(填字母序号).
a.盐酸不足,氨水剩余 b.氨水与盐酸恰好完全反应 c.盐酸过量
②当溶液中c(NH4+)=c(Cl-)时,用含a的代数式表示NH3•H2O的电离常数Kb=$\frac{1{0}^{-8}}{a-0.1}$.
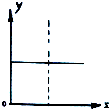
| A. | N2(g)+3H2(g)?2NH3(g),恒容条件下达到平衡后充入He,N2的转化率与时间的关系 | |
| B. | CH4(g)+H2O(g)?CO(g)+3H2(g);△H>0,平衡后CH4的物质的量与△H的关系 | |
| C. | FeCl3+3KSCN?Fe(SCN)3+3KCl,平衡后加入KCl固体,c(Cl-)与正反应速率关系 | |
| D. | H2(g)+I2(g)?2HI(g),平衡后缩小容器容积,速率与时间的关系 |
| A. | 质子数与中子数相等的硫原子:${\;}_{16}^{32}$S | |
| B. | Al3+的结构示意图: | |
| C. | CaO2的电子式: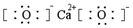 | |
| D. | 2-溴丙烷的结构简式:C3H7Br |