题目内容
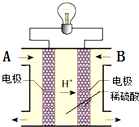
 甲醇(CH3OH)燃料电池可用作电动汽车电源,如图为电池示意图.在电池的一极通入甲醇,另一极通入氧气,工作时H+由负极移向正极.下列叙述不正确的是( )
甲醇(CH3OH)燃料电池可用作电动汽车电源,如图为电池示意图.在电池的一极通入甲醇,另一极通入氧气,工作时H+由负极移向正极.下列叙述不正确的是( )| A、外电路通过0.6 mol电子时,理论上消耗甲醇3.2 g |
| B、通甲醇一端为负极 |
| C、正极反应为:O2+4H++4e-=2H2O |
| D、负极反应为:CH3OH+H2O+6e-=CO2↑+6H+ |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:燃料电池中负极上是燃料发生失电子的氧化反应,正极上是氧气发生得电子的还原反应,电子从负极流向正极,可以根据电极反应来计算转移电子和消耗甲醇的量之间的关系.
解答:
解:A、反应2CH3OH+3O2=2CO2+4H2中,消耗2mol的甲醇,转移电子的物质的量是12mol,所以当转移0.6mole-时,消耗的甲醇0.1mol即3.2g,故A正确;
B、燃料电池中,负极上是燃料发生失电子的氧化反应,则通甲醇一极为负极,故B正确;
C、燃料电池正极上是氧气发生得电子的还原反应,在酸性电解质下,正极电极反应式为:3O2+12H++12e-=6H2O,故C正确;
D、负极上是燃料发生失电子的氧化反应,则通甲醇一极为负极,酸性条件下,生成二氧化碳,则负极反应为CH3OH+H2O-6e-=CO2↑+6H+,故D错误.
故选D.
B、燃料电池中,负极上是燃料发生失电子的氧化反应,则通甲醇一极为负极,故B正确;
C、燃料电池正极上是氧气发生得电子的还原反应,在酸性电解质下,正极电极反应式为:3O2+12H++12e-=6H2O,故C正确;
D、负极上是燃料发生失电子的氧化反应,则通甲醇一极为负极,酸性条件下,生成二氧化碳,则负极反应为CH3OH+H2O-6e-=CO2↑+6H+,故D错误.
故选D.
点评:本题考查学生燃料电池的工作原理知识,根据原电池原理确定电极和电极方程式,题目难度不大.

练习册系列答案
相关题目
用1molMnO2和含HCl为4mol的浓盐酸充分反应(共热),在不考虑HCl挥发的情况下,得到的氯气的物质的量( )
| A、等于2mol |
| B、等于1mol |
| C、小于1 mol |
| D、大于2 mol |
 用吸附了氢气的纳米碳管等材料制作的二次电池的原理如图所示.下列说法正确的是( )
用吸附了氢气的纳米碳管等材料制作的二次电池的原理如图所示.下列说法正确的是( )| A、放电时,负极的电极反应为:H2-2e-+2OH-=2H2O |
| B、充电时,阳极的电极反应为:Ni(OH)2+OH--e-=NiO(OH)+H2O |
| C、放电时,OH-移向镍电极 |
| D、充电时,将电池的碳电极与外电源的正极相连 |
与OH-具有相同电子数和质子数的是( )
| A、NH3 |
| B、Na+ |
| C、F- |
| D、NH4+ |
用NA表示阿伏加德罗常数的值.下列说法一定正确的是( )
| A、1 mol苯乙烯中含碳碳双键数为4NA |
| B、30 g 甲醛和醋酸的混合物中含碳原子数目为NA |
| C、标准状况下,22.4 L空气含单质分子数目为NA |
| D、0.5 mol Na2O2溶解于1 L水中得Na+的物质的量浓度为1 mol?L-1 |
下列物质均能与水发生反应形成新的物质.下列化学方程式中正确的是( )
①ICl+H2O═HI+HClO
②CH3COCl+H2O→CH3COOH+HCl
③SiCl4+4H2O═H4SiO4+4HCl
④Mg3N2+6H2O═3Mg(OH)2+2NH3↑
①ICl+H2O═HI+HClO
②CH3COCl+H2O→CH3COOH+HCl
③SiCl4+4H2O═H4SiO4+4HCl
④Mg3N2+6H2O═3Mg(OH)2+2NH3↑
| A、①④ | B、②③ |
| C、①②④ | D、②③④ |
下列有关原电池的叙述中,错误的是( )
| A、原电池是将化学能转化为电能的装置 |
| B、用导线连接的两种不同金属同时插入液体中,能形成原电池 |
| C、在原电池中,电子流出的一极是负极,发生氧化反应 |
| D、在原电池放电时,电解质溶液中的阳离子向正极移动 |
 为解决环境、能源等问题,科学家正研究将CO2转化为CH3OH技术. 该转化反应为CO2+3H2=CH3OH+H2O.
为解决环境、能源等问题,科学家正研究将CO2转化为CH3OH技术. 该转化反应为CO2+3H2=CH3OH+H2O.