题目内容
设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A、常温常压下,11.2 L氧气所含的原子数为NA |
| B、1.8g的NH4+离子中含有的电子数为10NA |
| C、常温常压下,48g O3含有的氧原子数为3NA |
| D、0.1mol/L的FeCl3溶液所含Cl-数目为0.3NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、依据气体摩尔体积的应用条件是标准状况计算气体物质的量分析判断;
B、依据n=
计算物质的量结合铵根离子计算电子数;
C、依据n=
计算物质的量结合分子式计算氧原子数;
D、溶液体积不知不能计算微粒数;
B、依据n=
| m |
| M |
C、依据n=
| m |
| M |
D、溶液体积不知不能计算微粒数;
解答:
解:A、气体摩尔体积的应用条件是标准状况计算气体物质的量,常温常压下,11.2 L氧气物质的量不是0.5mol,故A错误;
B、依据n=
计算物质的量=
=0.1mol,结合铵根离子含10个电子计算电子数=0.1mol×10×NA=NA,故B错误;
C、依据n=
计算物质的量=
=1mol,结合分子式计算氧原子数3NA,故C正确;
D、溶液体积不知不能计算微粒数,故D错误;
故选C.
B、依据n=
| m |
| M |
| 1.8g |
| 18g/mol |
C、依据n=
| m |
| M |
| 48g |
| 48g/mol |
D、溶液体积不知不能计算微粒数,故D错误;
故选C.
点评:本题考查了阿伏伽德罗常数的分析应用,主要是气体摩尔体积的条件应用,质量换算物质的量计算微粒数的方法,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
 短周期元素X、Y、Z、W在元素周期表中的位置如图所示,Z原子最外层电子数是其电子层数的2倍,下列叙述正确的是( )
短周期元素X、Y、Z、W在元素周期表中的位置如图所示,Z原子最外层电子数是其电子层数的2倍,下列叙述正确的是( )| A、原子半径的大小顺序为:rZ>rW>rX>rY |
| B、元素W的含氧酸的酸性一定比Z的含氧酸的酸性强 |
| C、工业上是通过电解法获得元素W的单质 |
| D、XZ2和XW4中化学键的类型不同 |
 某有机物A的结构简式如图,下列有关A的说法正确的是( )
某有机物A的结构简式如图,下列有关A的说法正确的是( )| A、分子式为:C14H25O6NBr |
| B、该有机物能发生水解反应,但不能发生消去反应 |
| C、该有机物能使酸性高锰酸钾溶液褪色 |
| D、A在一定条件下与氢氧化钠溶液反应,1 molA最多消耗4mol NaOH |
除去括号内杂质所用试剂和方法不正确的是( )
| A、Cu(Fe)--加盐酸,过滤 |
| B、乙醇(水)--加生石灰,蒸馏 |
| C、KNO3溶液(KCl)--降温结晶,过滤 |
| D、CO2(HCl)--饱和NaOH溶液,洗气 |
设NA为阿伏加德罗常数,下列说法中正确的是( )
| A、5.6g铁片投入到冷的浓硫酸中,铁片失去电子数为0.3NA |
| B、16g CH4中含有4NA个C-H键 |
| C、标准状况下,3g NO与1.6g O2混合气体所含有的分子数为0.1NA |
| D、标准状况下,5.6L四氯化碳含有的分子数为0.25NA |
下列关于胶体的叙述中正确的是( )
| A、液溶胶是一种液态混合物属于分散系的一种 |
| B、直径介于1 nm~10 nm之间的微粒称为胶体 |
| C、胶体的本质特征是发生丁达尔效应 |
| D、用过滤器可以将胶体和溶液分开 |
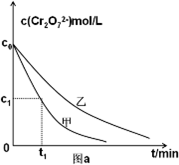
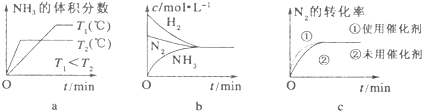
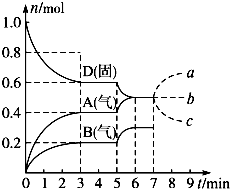 在容积为2.0L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,据图回答下列问题:
在容积为2.0L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,据图回答下列问题: