题目内容
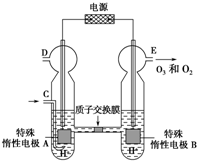 臭氧O3是常用消毒剂,实验室可用电解稀硫酸制备,装置如图(已知溶液中放电顺序:O2>H+).下列说法正确的是( )
臭氧O3是常用消毒剂,实验室可用电解稀硫酸制备,装置如图(已知溶液中放电顺序:O2>H+).下列说法正确的是( )| A、若C处通入O2,电解时溶液中的质子由A极向B极迁移 | ||||
| B、若C处通入O2,A极的电极反应式为:2H++2e-═H2↑ | ||||
C、若C处不通入O2,该制备过程总反应的化学方程式为:3O2
| ||||
D、若C处不通入O2,D、E处分别收集到x L和y L气体(标准状况下),则E处收集的y L气体中O3所占的体积分数为
|
考点:电解原理
专题:电化学专题
分析:根据图象知,B电极上生成O2、O3,说明B电极上失电子发生氧化反应,则B是阳极,A是阴极,
B电极上发生的反应为2H2O-4e-=O2↑+4H+或3H2O-6e-=O3↑+6H+,
A.若C处通入O2,电解时溶液中的质子向阴极移动;
B.若C处通入O2,溶液中放电顺序:O2>H+,所以A极电极反应式为O2+4H++4e-=2H2O;
C.若C处不通入O2,A极电极反应式为2H++2e-═H2↑,制备臭氧的总反应为3H2O
3H2↑+2O3↑;
D.相同条件下,气体的体积之比等于其物质的量之比,再结合转移电子相等进行计算.
B电极上发生的反应为2H2O-4e-=O2↑+4H+或3H2O-6e-=O3↑+6H+,
A.若C处通入O2,电解时溶液中的质子向阴极移动;
B.若C处通入O2,溶液中放电顺序:O2>H+,所以A极电极反应式为O2+4H++4e-=2H2O;
C.若C处不通入O2,A极电极反应式为2H++2e-═H2↑,制备臭氧的总反应为3H2O
| ||
D.相同条件下,气体的体积之比等于其物质的量之比,再结合转移电子相等进行计算.
解答:
解:根据图象知,B电极上生成O2、O3,说明B电极上失电子发生氧化反应,则B是阳极,A是阴极,
B电极上发生的反应为2H2O-4e-=O2↑+4H+或3H2O-6e-=O3↑+6H+,
A.若C处通入O2,电解时溶液中的质子向阴极移动,所以质子由B向A极移动,故A错误;
B.若C处通入O2,溶液中放电顺序:O2>H+,所以A电极上生成水而不是氢气,则A极电极反应式为O2+4H++4e-=2H2O,故B错误;
C.若C处不通入O2,A极上氢离子放电而不是氧气放电,所以A电极反应式为2H++2e-═H2↑,制备臭氧的总反应为:3H2O
3H2↑+2O3↑,故C错误;
D.若C处不通入O2,A电极上氢离子放电,相同条件下,气体的体积之比等于其物质的量之比,阴阳极上转移电子相等,则2x=6V(O3)+4[y-V(O3)],V(O3)=(x-2y)L,所以E处收集的yL气体中臭氧所占的体积分数为
,故D正确;
故选D.
B电极上发生的反应为2H2O-4e-=O2↑+4H+或3H2O-6e-=O3↑+6H+,
A.若C处通入O2,电解时溶液中的质子向阴极移动,所以质子由B向A极移动,故A错误;
B.若C处通入O2,溶液中放电顺序:O2>H+,所以A电极上生成水而不是氢气,则A极电极反应式为O2+4H++4e-=2H2O,故B错误;
C.若C处不通入O2,A极上氢离子放电而不是氧气放电,所以A电极反应式为2H++2e-═H2↑,制备臭氧的总反应为:3H2O
| ||
D.若C处不通入O2,A电极上氢离子放电,相同条件下,气体的体积之比等于其物质的量之比,阴阳极上转移电子相等,则2x=6V(O3)+4[y-V(O3)],V(O3)=(x-2y)L,所以E处收集的yL气体中臭氧所占的体积分数为
| x-2y |
| y |
故选D.
点评:本题考查了电解原理,明确A电极上通入氧气和不通氧气发生反应的区别是解本题关键,再结合离子的移动方向转移电子相等进行解答即可,题目难度中等.

练习册系列答案
相关题目
下列说法中,不正确的是( )
| A、在元素周期表里,元素所在主族的族序数等于其原子核外最外层电子数 |
| B、在元素周期表里,元素所在的周期数等于原子电子层数 |
| C、最外层电子数为8的微粒是稀有气体元素的原子 |
| D、同主族元素的原子序数越大,其原子半径越大 |
分类是学习和研究化学的一种重要方法,下列分类合理的是( )
| A、H2SO4和HNO3都属于酸 |
| B、K2CO3和K2O都属于盐 |
| C、KOH和Na2CO3都属于碱 |
| D、Na2O和Na2SiO3都属于氧化物 |
设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A、常温常压下,17g甲基(-14CH3)所含的中子数为9NA |
| B、标准状况下,11.2L苯中含有的碳碳双键数为1.5NA |
| C、42.0g乙烯和丙烯的混合气体中含有的碳原子数为3NA |
| D、5.6g铁与0.1mol氯气在点燃条件下充分反应,转移的电子数为0.3NA |
短周期元素X、Y、Z、Q、R,原子序数依次增大.X、Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素.
由以上某些元素组成的化合物A、B、C、D有如下转化关系:A
B(在水溶液中进行);已知C是溶于水显酸性的气体;D是淡黄色固体.下列叙述错误的是( )
由以上某些元素组成的化合物A、B、C、D有如下转化关系:A
| C |
| D |
A、D的电子式为: |
| B、X与Y能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质的分子式为:C2H2 |
| C、五种元素原子半径由大到小的顺序是:Q>R>Y>Z>X |
| D、A转化为B的离子方程式一定是:2AlO2-+3H2O+CO2→2Al(OH)3↓+CO32- |
下列玻璃仪器中,不能用于加热的有( )
| A、烧杯 | B、容量瓶 |
| C、量筒 | D、试剂瓶 |
下列关于卤素的叙述中正确的是( )
| A、溴中溶有少量氯气,可以用加入溴化钠再用酒精萃取的方法提纯 |
| B、用加热的方法可将碳酸氢钠固体中混有的少量碘除去 |
| C、氟气跟氯化钠水溶液反应,一定有HF和O2生成 |
| D、氯气跟水反应时,水既是氧化剂也是还原剂 |
已知:常温下浓度为0.1mol/L的下列溶液的pH如表:
下列有关说法正确的是( )
| 溶质 | NaF | NaClO | Na2CO3 |
| pH | 7.5 | 9.7 | 11.6 |
| A、在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF |
| B、若将CO2通入0.1mol/L Na2CO3溶液中至溶液中性,则溶液中2c(CO32-)+c(HCO3-)=0.1mol/L |
| C、根据上表,水解方程式ClO-+H2O?HClO+OH-的平衡常数K=10-7.6 |
| D、向上述NaClO溶液中通HF气体至恰好完全反应时:c(Na+)>c(F-)>c(H+)>c(HClO)>c(OH-) |
已知A、B、C均为短周期的元素,A、B同周期、A、C的最低价离子分别为A2-和C-,B2+和C-具有相同的电子层结构,下列说法正确的是( )
| A、C元素的最高正价为+7价 |
| B、离子半径:A2->C->B2+ |
| C、对应气态氢化物的稳定性:A>C |
| D、还原性:A2->C- |