题目内容
已知:常温下浓度为0.1mol/L的下列溶液的pH如表:
下列有关说法正确的是( )
| 溶质 | NaF | NaClO | Na2CO3 |
| pH | 7.5 | 9.7 | 11.6 |
| A、在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF |
| B、若将CO2通入0.1mol/L Na2CO3溶液中至溶液中性,则溶液中2c(CO32-)+c(HCO3-)=0.1mol/L |
| C、根据上表,水解方程式ClO-+H2O?HClO+OH-的平衡常数K=10-7.6 |
| D、向上述NaClO溶液中通HF气体至恰好完全反应时:c(Na+)>c(F-)>c(H+)>c(HClO)>c(OH-) |
考点:离子浓度大小的比较,弱电解质在水溶液中的电离平衡,盐类水解的应用
专题:电离平衡与溶液的pH专题,盐类的水解专题
分析:相同浓度的钠盐溶液碱性越强,说明酸根离子水解程度越大,则相应酸的酸性越弱,酸的电离平衡常数越小,根据钠盐溶液的pH知,酸根离子水解程度CO32->ClO->F-,酸的电离平衡常数从小到大顺序是:HCO3-<HClO<HF,以此解答该题.
解答:
解:相同浓度的钠盐溶液碱性越强,说明酸根离子水解程度越大,则相应酸的酸性越弱,酸的电离平衡常数越小,根据钠盐溶液的pH知,酸根离子水解程度CO32->ClO->F-,酸的电离平衡常数从小到大顺序是:HCO3-<HClO<HF,
A.酸的电离平衡常数从小到大顺序是:HCO3-<HClO<HF,在相同温度下,同浓度的三种酸溶液的导电能力顺序:HCO3-<HClO<HF,但酸性H2CO3>HClO,故A错误;
B.溶液存在电荷守恒c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-),溶液呈中性,则c(H+)=c(OH-),所以c(Na+)=c(HCO3-)+2c(CO32-)=0.2mol/L,故B错误;
C.式ClO-+H2O?HClO+OH-的平衡常数为K=
=
=10-7.6,故C正确;
D.反应后生成HClO,由于电离程度较弱,则c(HClO)>c(H+),故D错误.
故选C.
A.酸的电离平衡常数从小到大顺序是:HCO3-<HClO<HF,在相同温度下,同浓度的三种酸溶液的导电能力顺序:HCO3-<HClO<HF,但酸性H2CO3>HClO,故A错误;
B.溶液存在电荷守恒c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-),溶液呈中性,则c(H+)=c(OH-),所以c(Na+)=c(HCO3-)+2c(CO32-)=0.2mol/L,故B错误;
C.式ClO-+H2O?HClO+OH-的平衡常数为K=
| c(HClO)×c(OH-) |
| c(ClO-) |
| 10-4.3×10-4.3 |
| 0.1 |
D.反应后生成HClO,由于电离程度较弱,则c(HClO)>c(H+),故D错误.
故选C.
点评:本题考查较为综合,涉及弱电解质的电离和盐类的水解,为高频考点,注意从电荷守恒的角度解答,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列关于化学反应速率的说法,错误的是( )
| A、化学反应速率通常用单位时间内反应物浓度的增加量或生成物浓度的减少量来表示 |
| B、化学反应速率的数值无负值,均为正值 |
| C、不能用固体或纯液体的浓度变化量表示化学反应速率 |
| D、化学反应速率的单位是mol/(L?s)或mol/(L?min) |
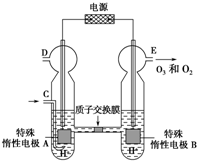 臭氧O3是常用消毒剂,实验室可用电解稀硫酸制备,装置如图(已知溶液中放电顺序:O2>H+).下列说法正确的是( )
臭氧O3是常用消毒剂,实验室可用电解稀硫酸制备,装置如图(已知溶液中放电顺序:O2>H+).下列说法正确的是( )| A、若C处通入O2,电解时溶液中的质子由A极向B极迁移 | ||||
| B、若C处通入O2,A极的电极反应式为:2H++2e-═H2↑ | ||||
C、若C处不通入O2,该制备过程总反应的化学方程式为:3O2
| ||||
D、若C处不通入O2,D、E处分别收集到x L和y L气体(标准状况下),则E处收集的y L气体中O3所占的体积分数为
|
复印机工作时会产生一种腥臭味的气体,该气体只由氧元素组成,其化学式为( )
| A、O2 |
| B、NO2 |
| C、O3 |
| D、N2O |
下列关于①苯、②乙醇、③乙酸、④葡萄糖等有机物的叙述中,不正确的是( )
| A、一定条件下,可用苯与溴水制取溴苯 |
| B、②、③、④均能与金属钠反应 |
| C、①、②、③均能发生取代反应 |
| D、可以用新制氢氧化铜鉴别①、②、③、④ |
2SO2(g)+O2(g)?2SO3(g)△H<0是制备硫酸的重要反应.下列说法正确的是( )
| A、加入催化剂,反应速率加快,反应的△H变大 |
| B、将平衡后的混合气体用浓硫酸吸收,剩余的气体只有O2 |
| C、98%的浓硫酸用等体积的水稀释后,硫酸的质量分数为49% |
| D、若以稀硫酸为电解液,将该反应设计成原电池,放电过程中负极附近溶液的pH不断减小 |
100.0mL 6.0mol?L-1 H2SO4(aq)跟足量锌粉反应,在一定温度下,为了减缓反应进行的速率,但又不影响生成H2的总量,可向反应物中加入适量的( )
| A、Na2CO3(s) |
| B、水 |
| C、K2SO4(aq) |
| D、(NH4)2SO4(s) |
人体胃酸的主要成分是盐酸.胃酸可助消化食物,但胃酸过多会损伤胃粘膜,使人感觉不适.抗酸药(又称抑酸剂)可以减少胃过过多的胃酸.下列物质不属于抗酸药的是( )
A、阿司匹林(主要成分:)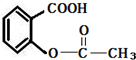 |
| B、胃舒平[主要成分:Al(OH)3] |
| C、碳酸氢钠片(主要成分:NaHCO3) |
| D、胃得乐(主要成分:MgCO3) |