题目内容
已知A、B、C均为短周期的元素,A、B同周期、A、C的最低价离子分别为A2-和C-,B2+和C-具有相同的电子层结构,下列说法正确的是( )
| A、C元素的最高正价为+7价 |
| B、离子半径:A2->C->B2+ |
| C、对应气态氢化物的稳定性:A>C |
| D、还原性:A2->C- |
考点:原子结构与元素周期律的关系
专题:元素周期律与元素周期表专题
分析:由A、C的最低价离子分别为A2-和C-,则A为ⅥA族元素,C为ⅦA族元素,B2+和C-具有相同的电子层结构,则B在C的下一周期,则B为Mg元素,C为F元素,A、B同周期,则A为S元素,
A.C为F元素,无正价;
B.具有相同核外电子结构的离子,核电荷数越大,半径越小;
C.非金属性越强的元素,其气态氢化物越稳定;
D.元素的非金属性越强,对应阴离子的还原性越弱.
A.C为F元素,无正价;
B.具有相同核外电子结构的离子,核电荷数越大,半径越小;
C.非金属性越强的元素,其气态氢化物越稳定;
D.元素的非金属性越强,对应阴离子的还原性越弱.
解答:
解:由A、C的最低价离子分别为A2-和C-,则A为ⅥA族元素,C为ⅦA族元素,B2+和C-具有相同的电子层结构,则B在C的下一周期,则B为Mg元素,C为F元素,A、B同周期,则A为S元素,
A.C为F元素,无正价,最高价为0价,故A错误;
B.离子的电子层数越多,半径越大,具有相同核外电子结构的离子,核电荷数越大,半径越小,所以A2->C->B2+,故B正确;
C.C为F元素,A为S元素,F的非金属性大于S元素,所以HF的稳定性大于H2S,即对应气态氢化物的稳定性A<C,故C错误;
D.元素的非金属性越强,对应阴离子的还原性越弱,则有A2->C-,故D正确.
故选BD.
A.C为F元素,无正价,最高价为0价,故A错误;
B.离子的电子层数越多,半径越大,具有相同核外电子结构的离子,核电荷数越大,半径越小,所以A2->C->B2+,故B正确;
C.C为F元素,A为S元素,F的非金属性大于S元素,所以HF的稳定性大于H2S,即对应气态氢化物的稳定性A<C,故C错误;
D.元素的非金属性越强,对应阴离子的还原性越弱,则有A2->C-,故D正确.
故选BD.
点评:本题考查原子结构与元素周期律的关系,为高频考点,侧重于学生的分析能力的考查,题目难度不大,本题的关键是根据原子结构特点正确推断元素的种类.

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案
相关题目
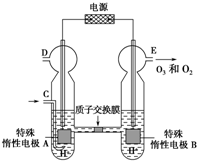 臭氧O3是常用消毒剂,实验室可用电解稀硫酸制备,装置如图(已知溶液中放电顺序:O2>H+).下列说法正确的是( )
臭氧O3是常用消毒剂,实验室可用电解稀硫酸制备,装置如图(已知溶液中放电顺序:O2>H+).下列说法正确的是( )| A、若C处通入O2,电解时溶液中的质子由A极向B极迁移 | ||||
| B、若C处通入O2,A极的电极反应式为:2H++2e-═H2↑ | ||||
C、若C处不通入O2,该制备过程总反应的化学方程式为:3O2
| ||||
D、若C处不通入O2,D、E处分别收集到x L和y L气体(标准状况下),则E处收集的y L气体中O3所占的体积分数为
|
100.0mL 6.0mol?L-1 H2SO4(aq)跟足量锌粉反应,在一定温度下,为了减缓反应进行的速率,但又不影响生成H2的总量,可向反应物中加入适量的( )
| A、Na2CO3(s) |
| B、水 |
| C、K2SO4(aq) |
| D、(NH4)2SO4(s) |
在一定条件下,N2和O2于密闭容器中发生如下反应:2N2(g)+O2(g)?2N2O(g).下列说法能说明该反应达到化学平衡状态的有( )
| A、反应不再进行 |
| B、反应体系中的c(N2)不再发生变化 |
| C、c(N2O)=c(N2) |
| D、N2O的分解速率与生成速率相等 |
欲配制下列四种含大量阴、阳离子的溶液,其中配不成的是( )
| A、Ca2+、K+、Cl-、CO32- |
| B、K+、Na+、OH-、NO3- |
| C、Mg2+、Ca2+、Cl-、NO3- |
| D、K+、Al3+、SO42-、NO3- |
下列有关物质性质或应用的说法,正确的是( )
| A、制水泥和玻璃都用石灰石做原料 |
| B、利用Al2O3制作的坩埚,可用于熔融烧碱 |
| C、Si可用做太阳能电池和光导纤维的材料 |
| D、铜的金属活泼性比铁的弱,可在海轮外壳上装若干铜块以减缓其腐蚀 |
人体胃酸的主要成分是盐酸.胃酸可助消化食物,但胃酸过多会损伤胃粘膜,使人感觉不适.抗酸药(又称抑酸剂)可以减少胃过过多的胃酸.下列物质不属于抗酸药的是( )
A、阿司匹林(主要成分:)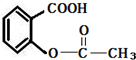 |
| B、胃舒平[主要成分:Al(OH)3] |
| C、碳酸氢钠片(主要成分:NaHCO3) |
| D、胃得乐(主要成分:MgCO3) |