题目内容
3.减少工业和生活废弃物的排放并合理开发利用,近年来受到了人们的普遍关注.I.利用工业废水中的CO2制取甲醇,反应为CO2+3H2$\stackrel{催化剂}{?}$CH3OH+H2O.
(1)已知下列反应的能量变化如图1所示:
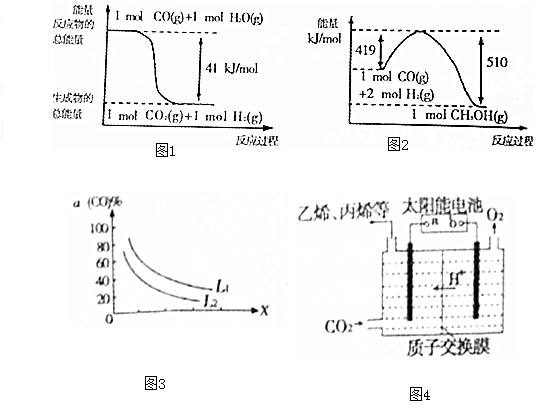
由二氧化碳和氢气制备甲醇的热化学方程式为CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-50kJ/mol.
II.利用工业废气CO合成甲醇,反应为CO(g)+2H2(g)?CH3OH(g).
(2)一定条件下,在1L密闭容器中充入0.6mol CO和1.4mol H2,8min后达到平衡,CO的转化率为50%,则8min内H2的平均反应速率为0.075mol/(L•min).
(3)若反应原料是来自煤的气化,已知该反应的平衡常数表达式为K=$\frac{c({H}_{2})•c(CO)}{c({H}_{2}O)}$,每生成1molH2需要吸收131.3kJ的热量.写出该反应的热化学方程式C(s)+H2O(g)=H2(g)+CO(g)△H=+131.3kJ/mol.
(4)t℃时,能发生如下反应:2CH3OH(g)?CH3OCH3(g)+H2O(g).已知反应平衡常数为400,此温度下,在1L密闭容器中加入-定量的甲醇,反应到某时刻测得各组分的物质的量浓度如表:
| 物质 | CH3OH | CH3OCH3 | H2O |
| c(mol•L-1) | 0.46 | 1.0 | 1.0 |
(5)已知反应 3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g),CO的平衡转化率a(CO)与温度、压强的关系如图2所示.图中X表示温度(填“温度”或“压强”),判断的理由是图中表明随着X增大,CO的平衡转化率减小;如果X表示压强,压强增大,平衡向正反应方向移动,CO的平衡转化率增大,不符合条件;如果X表示温度,温度升高,平衡向逆反应方向移动,CO的平衡转化率减小,符合条件..
(6)强酸性电解质溶液中,用惰性电极电解CO2可转化为多种燃料,其原理如图3所示.b为电源的正极.电解时,生成乙烯的电极反应式为2CO2+12H++12e-=C2H4+4H2O.
分析 (1)二氧化碳和氢气制备甲醇的化学方程式为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g),根据图1和图2的能量变化,写出热化学方程式,所求反应可由此推导,根据盖斯定律计算所求反应的焓变;
(2)反应为CO(g)+2H2(g)?CH3OH(g),一定条件下,在1L密闭容器中充入0.6mol CO和1.4mol H2,8min后达到平衡,反应经历的时间为△t=8min,CO的转化率为50%,则CO的反应转化的物质的量为△n=0.6mol×50%=0.3mol,容器的体积为V=1L,则CO的化学反应平均速率为$\overline{r}$(CO)=$\frac{△n}{V△t}$,根据化学反应速率之比等于计量数之比,据此计算H2的化学反应平均速率;
(3)若反应原料是来自煤的气化,已知该反应的平衡常数表达式为K=$\frac{c({H}_{2})•c(CO)}{c({H}_{2}O)}$,因此反应物为C(s)和H2O(g),生成物为H2(g)和CO(g),每生成1molH2需要吸收131.3kJ的热量,计算反应的焓变,由此写出反应的热化学方程式;
(4)t℃时,发生反应:2CH3OH(g)?CH3OCH3(g)+H2O(g),已知反应平衡常数为400,此温度下,在1L密闭容器中加入一定量的甲醇,根据反应商J与平衡常数K的关系,判断此时化学反应的方向,据此分析正逆反应的速率大小,温度不变,平衡常数不变,据此计算平衡时的c(CH3OCH3);
(5)反应为:3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g),反应为气体分子数减少的反应,增大压强,有利于平衡向正反应方向移动,CO的转化率升高,据此分析X的意义;
(6)强酸性电解质溶液中,用惰性电极电解CO2,根据装置的原理图,b连接的电极处产生O2,均是由-2价的O失电子而来,发生的是氧化反应,据此判断b连接的电极的性质,a连接的电极处由CO2生成乙烯,此过程为得到电子的反应,H+通过质子交换膜到达a连接的极处参与电极反应,据此写出a连接的电极的电极反应式.
解答 解:(1)二氧化碳和氢气制备甲醇的化学方程式为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g),根据图1和图2的能量变化,可知:
①CO(g)+H2O(g)═CO2(g)+H2(g)△H1=-41kJ/mol,
②CO(g)+2H2(g)═CH3OH(g)△H2=-91kJ/mol,
该反应可由②-①得到,根据盖斯定律,该反应的焓变为△H=△H2-△H1=-91-(-41)=-50kJ/mol,
则由二氧化碳和氢气制备甲醇的热化学方程式为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-50kJ/mol,
故答案为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-50kJ/mol;
(2)反应为CO(g)+2H2(g)?CH3OH(g),一定条件下,在1L密闭容器中充入0.6mol CO和1.4mol H2,8min后达到平衡,反应经历的时间为△t=8min,CO的转化率为50%,则CO的反应转化的物质的量为△n=0.6mol×50%=0.3mol,容器的体积为V=1L,则CO的化学反应平均速率为$\overline{r}$(CO)=$\frac{△n}{V△t}$=$\frac{0.3mol}{1L×8min}$=$\frac{0.3}{8}$mol/(L•min),根据化学反应速率之比等于计量数之比,则H2的化学反应平均速率为$\overline{r}({H}_{2})$=$\frac{0.3}{8}×$2=$\frac{0.3}{4}$mol/(L•min)=0.075mol/(L•min),
故答案为:0.075mol/(L•min);
(3)若反应原料是来自煤的气化,已知该反应的平衡常数表达式为K=$\frac{c({H}_{2})•c(CO)}{c({H}_{2}O)}$,因此反应物为C(s)和H2O(g),生成物为H2(g)和CO(g),每生成1molH2需要吸收131.3kJ的热量,则以1molH2(g)反应,反应的焓变为△H=+131.3kJ/mol,所以该反应的热化学方程式为:C(s)+H2O(g)=H2(g)+CO(g)△H=+131.3kJ/mol,
故答案为:C(s)+H2O(g)=H2(g)+CO(g)△H=+131.3kJ/mol;
(4)t℃时,发生反应:2CH3OH(g)?CH3OCH3(g)+H2O(g),已知反应平衡常数为400,此温度下,在1L密闭容器中加入一定量的甲醇,根据表中数据,此时的反应商J=$\frac{1.0mol/L×1.0mol/L}{(0.46mol/L)^{2}}$=$\frac{1}{0.4{6}^{2}}$=4.72<K,则此时化学反应向正反应方向进行,因此速率大小关系为:v(正)>v(逆),
温度不变,平衡常数不变,设平衡时CH3OH转化了2x,将其转化为等效平衡,则平衡时各组分的浓度为c(CH3OH)=0.46-2x,c(CH3OCH3)=c(H2O)=1+2x,则有K=$\frac{c({H}_{2}O)c(C{H}_{3}OC{H}_{3})}{{c}^{2}(C{H}_{3}OH)}$=$\frac{(1+x)(1+x)}{(0.46-2x)^{2}}$=400,可得x=0.2,因此平衡时c(CH3OCH3)=1+2x=1.2mol/L,
故答案为:>;1.2mol/L;
(5)反应为:3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g),反应为气体分子数减少的反应,增大压强,有利于平衡向正反应方向移动,CO的转化率升高,对于X,随着X的升高,CO的转化率降低,可见X不表示压强,应表示温度,判断的理由是:图中表明随着X增大,CO的平衡转化率减小;如果X表示压强,压强增大,平衡向正反应方向移动,CO的平衡转化率增大,不符合条件;如果X表示温度,温度升高,平衡向逆反应方向移动,CO的平衡转化率减小,符合条件,
故答案为:温度;图中表明随着X增大,CO的平衡转化率减小;如果X表示压强,压强增大,平衡向正反应方向移动,CO的平衡转化率增大,不符合条件;如果X表示温度,温度升高,平衡向逆反应方向移动,CO的平衡转化率减小,符合条件;
(6)强酸性电解质溶液中,用惰性电极电解CO2,根据装置的原理图,b连接的电极处产生O2,均是由-2价的O失电子而来,发生的是氧化反应,因此b连接的电极为电解池的阳极,则b为电源的正极,
a连接的电极处由CO2生成乙烯,此过程为得到电子的反应,H+通过质子交换膜到达a连接的极处参与电极反应,则a连接的电极的电极反应式为:2CO2+12H++12e-=C2H4+4H2O,此电极产生乙烯,
故答案为:正;2CO2+12H++12e-=C2H4+4H2O.
点评 本题主要考察化学原理部分知识,包含热化学方程式的书写,盖斯定律的应用,化学平衡的移动,反应商的计算,化学反应方向的判断,平衡常数的应用,电化学知识,涉及的知识点较多,考察综合能力,题目难度中等.

下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是
选项 | 叙述Ⅰ | 叙述Ⅱ |
A | 浓硝酸和稀硝酸都具有强氧化性 | 浓硝酸和稀硝酸均可使紫色石蕊试液先变红后褪色 |
B | 浓硫酸具有强氧化性和吸水性 | 浓硫酸可干燥H2和CO,不可干燥 SO2和NH3 |
C | SO2是酸性氧化物 | SO2可使含有酚酞的NaOH溶液褪色 |
D | 铵盐受热易分解 | NH4Cl和NH4HCO3均可用作氮肥和制取氨气 |
将一定量的SO2通入FeCl3溶液中,取混合溶液,分别进行下列实验,能证明SO2与FeCl3溶液发生氧化还原反应的是( )
操作 | 现象 | |
① | 加入NaOH溶液 | 有红褐色沉淀 |
② | 加入Ba(NO3)2溶液 | 有白色沉淀 |
③ | 加入酸性KMnO4溶液 | 紫色褪去 |
④ | 加入K3[Fe(CN)6](铁氰化钾)溶液 | 有蓝色沉淀 |
A.②④ B.④ C.②③④ D.①②③④
 ,该分子中共平面的原子最多有( )
,该分子中共平面的原子最多有( )| A. | 20个 | B. | 18个 | C. | 22个 | D. | 24个 |
| A. | 煤的气化和液化是物理变化 | |
| B. | 煤干馏可以得到甲烷、苯和氨等重要化工原料 | |
| C. | 溴苯中混有溴,加入KI溶液,振荡,用汽油萃取出溴 | |
| D. | 苯中含苯酚杂质,可用过量浓溴水,将苯酚转化为2,4,6-三溴苯酚沉淀,过滤除去 |
| A. | Na2O2 | B. | CO2 | C. | SO2 | D. | C2H4 |
 向含有0.2molFeI2的溶液中加入a molBr2。下列叙述不正确的是( )
向含有0.2molFeI2的溶液中加入a molBr2。下列叙述不正确的是( ) l2O7、P2O5、SO3、CO2均属于酸性氧化物
l2O7、P2O5、SO3、CO2均属于酸性氧化物 如图所示,组成一种原电池.试回答下列问题:
如图所示,组成一种原电池.试回答下列问题: