题目内容
下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是
选项 | 叙述Ⅰ | 叙述Ⅱ |
A | 浓硝酸和稀硝酸都具有强氧化性 | 浓硝酸和稀硝酸均可使紫色石蕊试液先变红后褪色 |
B | 浓硫酸具有强氧化性和吸水性 | 浓硫酸可干燥H2和CO,不可干燥 SO2和NH3 |
C | SO2是酸性氧化物 | SO2可使含有酚酞的NaOH溶液褪色 |
D | 铵盐受热易分解 | NH4Cl和NH4HCO3均可用作氮肥和制取氨气 |
练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
3.通常情况下能共存且能用浓硫酸干燥的气体组是( )
| A. | SO2、Cl2、H2S | B. | O2、H2、SO2 | C. | NO、H2、O2 | D. | CO、NH3、O2 |
4.我国古代四大发明中的黑火药为硝酸钾、硫磺和木炭的混合物,黑火药发生爆炸的反应式为:
2KNO3+S+3C$\frac{\underline{\;爆炸\;}}{\;}$K2S+N2↑+3CO2↑,下列有关叙述中正确的是( )
2KNO3+S+3C$\frac{\underline{\;爆炸\;}}{\;}$K2S+N2↑+3CO2↑,下列有关叙述中正确的是( )
| A. | 在黑火药爆炸的反应中,硝酸钾为氧化剂,硫磺和木炭为还原剂 | |
| B. | 在黑火药爆炸的反应中,当有1molKNO3反应时,转移电子的总物质的量为5mol | |
| C. | 三种反应物可以形成三种不同类型的晶体,三种生成物可以形成两种不同类型的晶体 | |
| D. | 在K2S晶体中,K+与S2-电子层结构相同,但K+半径大于S2-半径 |
1.某合金2.25克与足量稀硝酸反应得到标准状况下的气体1.12升,则该合金可能为( )
| A. | 锌铁 | B. | 铁铝 | C. | 铁铜 | D. | 不能确定 |
分部分中学化学常见元素原子结构及性质如表所示:
序号 | 元素 | 结构及性质 |
① | A | A是一种常见金属,它的一种氧化物是具有磁性的黑色晶体 |
② | B | B是一种常见金属,原子核外有三个电子层且最外层电子为偶数 |
③ | C | C的气态氢化物易液化常作制冷剂 |
④ | D | D为灰黑色具有金属光泽的固体,是太阳能电池板的常用材料 |
⑤ | E | E原子最外层电子数是内层电子总数的3倍 |
⑥ | F | F在周期表中可以排在ⅠA族,也有人提出排在ⅦA族 |
(1)A原子在周期表中的位置为______________,离子半径:B2+_________C3-(填"大于、小于或等于”)。
(2)简单气态氢化物的热稳定性:D__________E(填"大于、小于或等于”)。
(3)①F与E可以形成原子个数比分别为2∶1、1∶1的两种化合物X和Y,区别X与Y的水溶液的实验方法是________________。
②F与C组成的两种化合物M和N所含的电子数分别与X、Y相等,则M的电子式为__________,N的结构式为___________。
(4)用化学方程式表明C与E这两种元素的非金属性的强弱_________________。
3.减少工业和生活废弃物的排放并合理开发利用,近年来受到了人们的普遍关注.
I.利用工业废水中的CO2制取甲醇,反应为CO2+3H2$\stackrel{催化剂}{?}$CH3OH+H2O.
(1)已知下列反应的能量变化如图1所示:
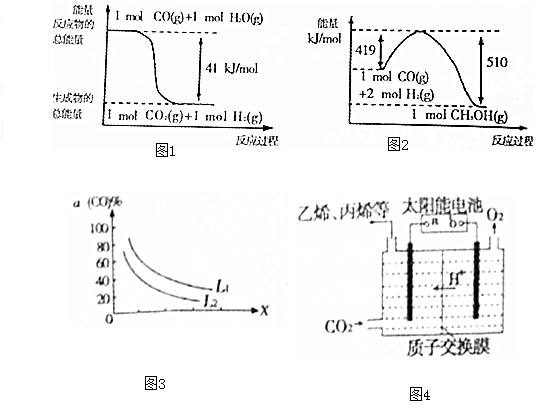
由二氧化碳和氢气制备甲醇的热化学方程式为CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-50kJ/mol.
II.利用工业废气CO合成甲醇,反应为CO(g)+2H2(g)?CH3OH(g).
(2)一定条件下,在1L密闭容器中充入0.6mol CO和1.4mol H2,8min后达到平衡,CO的转化率为50%,则8min内H2的平均反应速率为0.075mol/(L•min).
(3)若反应原料是来自煤的气化,已知该反应的平衡常数表达式为K=$\frac{c({H}_{2})•c(CO)}{c({H}_{2}O)}$,每生成1molH2需要吸收131.3kJ的热量.写出该反应的热化学方程式C(s)+H2O(g)=H2(g)+CO(g)△H=+131.3kJ/mol.
(4)t℃时,能发生如下反应:2CH3OH(g)?CH3OCH3(g)+H2O(g).已知反应平衡常数为400,此温度下,在1L密闭容器中加入-定量的甲醇,反应到某时刻测得各组分的物质的量浓度如表:
此刻正、逆反应速率的关系是:v(正)>v(逆)(填“>”“<”或“=”),平衡时c(CH3OCH3)的物质的量浓度是1.2mol/L.
(5)已知反应 3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g),CO的平衡转化率a(CO)与温度、压强的关系如图2所示.图中X表示温度(填“温度”或“压强”),判断的理由是图中表明随着X增大,CO的平衡转化率减小;如果X表示压强,压强增大,平衡向正反应方向移动,CO的平衡转化率增大,不符合条件;如果X表示温度,温度升高,平衡向逆反应方向移动,CO的平衡转化率减小,符合条件..
(6)强酸性电解质溶液中,用惰性电极电解CO2可转化为多种燃料,其原理如图3所示.b为电源的正极.电解时,生成乙烯的电极反应式为2CO2+12H++12e-=C2H4+4H2O.
I.利用工业废水中的CO2制取甲醇,反应为CO2+3H2$\stackrel{催化剂}{?}$CH3OH+H2O.
(1)已知下列反应的能量变化如图1所示:

由二氧化碳和氢气制备甲醇的热化学方程式为CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-50kJ/mol.
II.利用工业废气CO合成甲醇,反应为CO(g)+2H2(g)?CH3OH(g).
(2)一定条件下,在1L密闭容器中充入0.6mol CO和1.4mol H2,8min后达到平衡,CO的转化率为50%,则8min内H2的平均反应速率为0.075mol/(L•min).
(3)若反应原料是来自煤的气化,已知该反应的平衡常数表达式为K=$\frac{c({H}_{2})•c(CO)}{c({H}_{2}O)}$,每生成1molH2需要吸收131.3kJ的热量.写出该反应的热化学方程式C(s)+H2O(g)=H2(g)+CO(g)△H=+131.3kJ/mol.
(4)t℃时,能发生如下反应:2CH3OH(g)?CH3OCH3(g)+H2O(g).已知反应平衡常数为400,此温度下,在1L密闭容器中加入-定量的甲醇,反应到某时刻测得各组分的物质的量浓度如表:
| 物质 | CH3OH | CH3OCH3 | H2O |
| c(mol•L-1) | 0.46 | 1.0 | 1.0 |
(5)已知反应 3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g),CO的平衡转化率a(CO)与温度、压强的关系如图2所示.图中X表示温度(填“温度”或“压强”),判断的理由是图中表明随着X增大,CO的平衡转化率减小;如果X表示压强,压强增大,平衡向正反应方向移动,CO的平衡转化率增大,不符合条件;如果X表示温度,温度升高,平衡向逆反应方向移动,CO的平衡转化率减小,符合条件..
(6)强酸性电解质溶液中,用惰性电极电解CO2可转化为多种燃料,其原理如图3所示.b为电源的正极.电解时,生成乙烯的电极反应式为2CO2+12H++12e-=C2H4+4H2O.



 的传统合成路线如图所示:
的传统合成路线如图所示:

 H溶液,当金属离子全部沉淀时,得到2.54g沉淀。下列说法不正确的是
H溶液,当金属离子全部沉淀时,得到2.54g沉淀。下列说法不正确的是