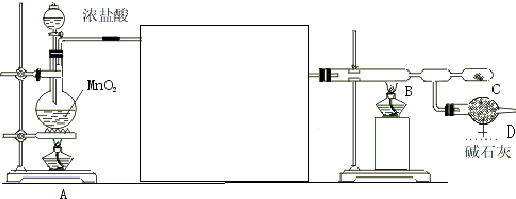
题目内容
5.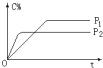 可逆反应A(气)+2B(气)?nC(气),在不同压强(P1、P2)下,测得C的体积分数跟反应时间的关系如图所示,以下结论正确的是( )
可逆反应A(气)+2B(气)?nC(气),在不同压强(P1、P2)下,测得C的体积分数跟反应时间的关系如图所示,以下结论正确的是( )| A. | P1>P2,n>3 | B. | P1>P2,n<3 | C. | P1<P2,n<3 | D. | P1<P2,n>3 |
分析 由图可知压强为P2先到达平衡,根据“先拐先平数值大”可知P2>P1,压强越大A的质量分数越小,增大压强平衡向正反应方向移动,据此判断n的值.
解答 解:由图可知压强为P2先到达平衡,由于“先拐先平数值大”,则P2>P1,
压强越大A的质量分数越小,增大压强平衡向正反应方向移动,增大压强平衡向气体气体减小的方向移动,则n<1+2=3,
故选C.
点评 本题考查化学平衡影响影响因素,题目难度中等,注意根据“先拐先平数值大”判断压强,再根据压强对平衡的影响解答,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案
相关题目
16.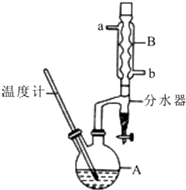 正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如下:2CH3CH2CH2CH2OH$?_{135℃}^{浓硫酸}$(CH3CH2CH2CH2)2O+H2O,反应物和产物的相关数据如表:
正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如下:2CH3CH2CH2CH2OH$?_{135℃}^{浓硫酸}$(CH3CH2CH2CH2)2O+H2O,反应物和产物的相关数据如表:
①将6mL浓硫酸和37g正丁醇,按一定顺序添加到A中,并加几粒沸石.
②加热A中反应液,迅速升温至135℃,维持反应一段时间.
③分离提纯:待A中液体冷却后将其缓慢倒入盛有70mL水的温度分液漏斗中,振摇后静置,分液得粗产物.
④粗产物依次用40mL水、20mL NaOH溶液和40mL水洗涤,分液后加入约3g无水氯化钙颗粒,静置一段时间后弃去氯化钙.
⑤将上述处理过的粗产物进行蒸馏,收集馏分,得纯净正丁醚11g.请回答:
(1)步骤①中浓硫酸和正丁醇的添加顺序为:应先加正丁醇.
(2)加热A前,需先从b (填“a”或“b”)口向B中通入水.
(3)步骤③的目的是初步洗去浓H2SO4,振摇后静置,粗产物应上 (填“上”或“下”)口倒出.
(4)步骤⑤中,加热蒸馏时应收集D (填选项字母)左右的馏分.
A.100℃B.117℃C.135℃D.142℃
(5)反应过程中会观察到分水器中收集到液体物质,且分为上下两层,随着反应的进行,分水器中液体逐渐增多至充满时,上层液体会从左侧支管自动流回A.分水器中上层液体的主要成分为正丁醇,下层液体的主要成分为水.
(6)本实验中,正丁醚的产率为34% (精确到1%).
 正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如下:2CH3CH2CH2CH2OH$?_{135℃}^{浓硫酸}$(CH3CH2CH2CH2)2O+H2O,反应物和产物的相关数据如表:
正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如下:2CH3CH2CH2CH2OH$?_{135℃}^{浓硫酸}$(CH3CH2CH2CH2)2O+H2O,反应物和产物的相关数据如表:| 相对分子质量 | 沸点/℃ | 密度/(g/cm3) | 水中的溶解性 | |
| 正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
| 正丁醚 | 130 | 142.0 | 0.7704 | 几乎不容 |
②加热A中反应液,迅速升温至135℃,维持反应一段时间.
③分离提纯:待A中液体冷却后将其缓慢倒入盛有70mL水的温度分液漏斗中,振摇后静置,分液得粗产物.
④粗产物依次用40mL水、20mL NaOH溶液和40mL水洗涤,分液后加入约3g无水氯化钙颗粒,静置一段时间后弃去氯化钙.
⑤将上述处理过的粗产物进行蒸馏,收集馏分,得纯净正丁醚11g.请回答:
(1)步骤①中浓硫酸和正丁醇的添加顺序为:应先加正丁醇.
(2)加热A前,需先从b (填“a”或“b”)口向B中通入水.
(3)步骤③的目的是初步洗去浓H2SO4,振摇后静置,粗产物应上 (填“上”或“下”)口倒出.
(4)步骤⑤中,加热蒸馏时应收集D (填选项字母)左右的馏分.
A.100℃B.117℃C.135℃D.142℃
(5)反应过程中会观察到分水器中收集到液体物质,且分为上下两层,随着反应的进行,分水器中液体逐渐增多至充满时,上层液体会从左侧支管自动流回A.分水器中上层液体的主要成分为正丁醇,下层液体的主要成分为水.
(6)本实验中,正丁醚的产率为34% (精确到1%).
20.下列元素的电负性最大的是( )
| A. | O | B. | S | C. | P | D. | C |
10.有关合成氨工业的说法中,正确的是( )
| A. | 从合成塔出来的混合气体,其中NH3只占15%,所以合成氨工厂的效率都很低 | |
| B. | 由于氨易液化,N2、H2是循环使用,所以总体来说氨的产率很高 | |
| C. | 合成氨工业的反应温度控制在500℃左右,目的是使化学平衡向正反应方向移动 | |
| D. | 合成氨工厂采用的压强是2×107~5×107Pa,因为在该压强下铁触媒的活性最大 |
17.天然气与二氧化碳在一定条件下反应制备合成气(CO+H2)的原理是CH4(g)+CO2(g)?2CO(g)+2H2(g)△H>0.该反应达到平衡之后,为了提高CH4的转化率,下列措施正确的是( )
| A. | 增大压强 | B. | 升高温度 | C. | 增大CH4浓度 | D. | 更换高效催化剂 |
14.若初始时在恒容密闭容器中加入N2O5,表为N2O5分解反应在一定温度下不同时间测得N2O5浓度的部分实验数据:
①写出该反应的平衡常数表达式:K=$\frac{{c}^{4}(N{O}_{2})•c({O}_{2})}{{c}^{2}({N}_{2}{O}_{5})}$.
②1000s内N2O5的分解速率为:0.00252mol/(L•s).
③若每有1mol N2O5分解,吸收Q kJ的热量,写出该分解反应的热化学方程式2N2O5(g)=4NO2(g)+O2(g)△H=+2QkJ/mol.
| t/s | 0 | 500 | 1000 |
| c(N2O5) mol/L | 5.00 | 3.25 | 2.48 |
②1000s内N2O5的分解速率为:0.00252mol/(L•s).
③若每有1mol N2O5分解,吸收Q kJ的热量,写出该分解反应的热化学方程式2N2O5(g)=4NO2(g)+O2(g)△H=+2QkJ/mol.
15.已知:2H2O2(l)═2H2O(l)+O2(g)△H=-98kJ•mol-1.在含少量I-的溶液中,H2O2分解反应过程为:
i.H2O2(l)+I-(aq)═H2O(l)+IO-(aq)△H1
ii.H2O2(l)+IO-(aq)═H2O(l)+O2(g)+I-(aq)△H2
下列说法不正确的是( )
i.H2O2(l)+I-(aq)═H2O(l)+IO-(aq)△H1
ii.H2O2(l)+IO-(aq)═H2O(l)+O2(g)+I-(aq)△H2
下列说法不正确的是( )
| A. | △H1+△H2=△H | |
| B. | I-是H2O2分解反应的催化剂 | |
| C. | 欲分解2 mol H2O2(l),至少需要提供98 kJ的热量 | |
| D. | 若生成1 mol O2,则反应ii转移电子的物质的量为2 mol |