题目内容
18.下列对乙烯和和聚乙烯的描述中,不正确的是( )| A. | 乙烯是纯净物,聚乙烯是混合物,都能使酸性KMnO4溶液褪色 | |
| B. | 取等质量的乙烯和和聚乙烯完全燃烧后,生成的CO2和H2O的质量分别相等 | |
| C. | 常温下乙烯为气态,聚乙烯为固态 | |
| D. | 乙烯可以发生加成聚合反应生成聚乙烯,聚乙烯的单体是乙烯 |
分析 乙烯含有碳碳双键,可发生加成、加聚和氧化反应,乙烯加聚生成聚乙烯,二者最简式相同,以此解答.
解答 解:A.聚乙烯不含碳碳双键,与高锰酸钾不反应,故A错误;
B.乙烯是聚乙烯的单体,它们的最简式相同,它们含C和H的质量分数分别相等,所以等质量的两者燃烧时生成CO2、H2O的量分别相等,故B正确;
C.聚乙烯相对分子质量较大,相对分子质量较大,为固体,故C正确;
D.乙烯含有碳碳双键,发生加聚反应可生成聚乙烯,为聚乙烯的单体,故D正确.
故选A.
点评 本题考查有机物的结构和性质,为高频考点,侧重考查学生的分析能力,注意把握常见有机物的组成、结构、性质以及应用,难度不大.

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
| A. | 用④分离NaCl溶液和花生油 | B. | 用③分离CCl4和水 | ||
| C. | 用⑤吸收CO2 | D. | 用①和②进行粗盐提纯 |
| A. | 0.5mol熔融的NaHSO4中含有的离子数目为1.5NA | |
| B. | 标准状况下,2.24LCl2溶于水,转移电子数为0.1NA | |
| C. | 氢气与氯气反应生成标准状况下22.4L氯化氢,则断裂化学键总数为NA | |
| D. | 电解精练铜时,转移1mol电子时,阳极溶解的铜的质量为32g |
(1)CO2的低碳转型对抵御气候变化具有重要意义,海洋是地球上碳元素最大的“吸收池”.
①溶于海水中的CO2主要以四种无机碳形式存在,除CO2、H2CO3两种分子外,还有两种离子的化学式为HCO3-、CO32-.
②在海洋碳循环中,可通过图1所示的途径固碳.写出钙化作用的离子方程式:Ca2++2HCO3-═CaCO3↓+CO2↑+H2O.
(2)将CO2与金属钠组合设计成Na-CO2电池,很容易实现可逆的充、放电反应,该电池反应为4Na+3CO2 $?_{放电}^{放电}$2Na2CO3+C.放电时,在正极得电子的物质为CO2;充电时,阳极的反应式为C-4e-+2CO32-═3CO2.
(3)目前工业上有一种方法是用CO2和H2在230℃并有催化剂条件下转化生成甲醇蒸汽和水蒸气.图2表示恒压容器中0.5molCO2和1.5mol H2转化率达80%时的能量变化示意图.能判断该反应达到化学平衡状态的依据B、D(填字母).
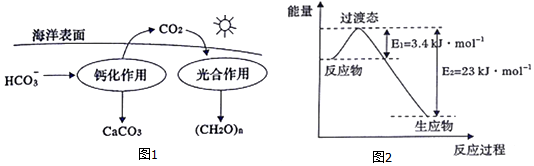
A.容器中压强不变 B.H2的体积分数不变
C.c(H2=3c(CH3OH) D.容器中密度不变
E.2个C=O断裂的同时有6个H-H断裂
(4)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如表三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b的值<1 (填具体值或取值范围).
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时v(正<v(逆)(填“<”、“>”或“=“).
(5)已知在常温常压下:
①2CH3OH(I)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ•mol-1
③H2O(g)=H2O(I)△H=-44.0kJ•mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式CH3OH(l)+O2(g)═CO(g)+2H2O(l)△H=-442.8kJ/mol.
 ,
, 叫狄尔斯阿德而反应,用 于构建六元环,则下列说法不正确的是( )
叫狄尔斯阿德而反应,用 于构建六元环,则下列说法不正确的是( )| A. | 狄尔斯阿德而反应为加成反应,原子利用率为100% | |
| B. |  可通过狄尔斯阿德而反应合成,而 可通过狄尔斯阿德而反应合成,而 不可通过狄尔斯阿德而反应合成 不可通过狄尔斯阿德而反应合成 | |
| C. | 2-甲基-1,3-丁二烯和丙炔发生上述反应产物有两种 | |
| D. |  可由环戊二烯与丙烯酸甲酯发生上述反应得到 可由环戊二烯与丙烯酸甲酯发生上述反应得到 |
| A. | SO2、Cl2、H2S | B. | O2、H2、SO2 | C. | NO、H2、O2 | D. | CO、NH3、O2 |
分部分中学化学常见元素原子结构及性质如表所示:
序号 | 元素 | 结构及性质 |
① | A | A是一种常见金属,它的一种氧化物是具有磁性的黑色晶体 |
② | B | B是一种常见金属,原子核外有三个电子层且最外层电子为偶数 |
③ | C | C的气态氢化物易液化常作制冷剂 |
④ | D | D为灰黑色具有金属光泽的固体,是太阳能电池板的常用材料 |
⑤ | E | E原子最外层电子数是内层电子总数的3倍 |
⑥ | F | F在周期表中可以排在ⅠA族,也有人提出排在ⅦA族 |
(1)A原子在周期表中的位置为______________,离子半径:B2+_________C3-(填"大于、小于或等于”)。
(2)简单气态氢化物的热稳定性:D__________E(填"大于、小于或等于”)。
(3)①F与E可以形成原子个数比分别为2∶1、1∶1的两种化合物X和Y,区别X与Y的水溶液的实验方法是________________。
②F与C组成的两种化合物M和N所含的电子数分别与X、Y相等,则M的电子式为__________,N的结构式为___________。
(4)用化学方程式表明C与E这两种元素的非金属性的强弱_________________。