题目内容
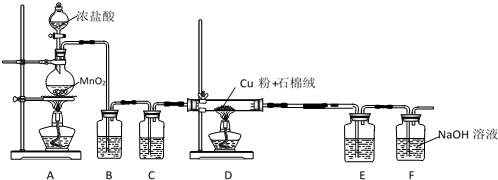
16.下列实验方法能达到实验目的是( )| A. | 用淀粉溶液检验溶液中是否存在碘单质 | |
| B. | 用分液漏斗分离乙酸乙酯与乙醇的混合物 | |
| C. | 用NaOH溶液除去乙酸乙酯中混有的乙酸 | |
| D. | 用排水集气法收集氨气 |
分析 A.淀粉遇到碘单质显示蓝色,据此可检验碘单质;
B.乙酸乙酯与乙醇不分层,无法通过分液分离;
C.乙酸乙酯与氢氧化钠溶于反应;
D.氨气极易溶于水,不能用排水法收集.
解答 解:A.由于淀粉遇到碘单质显示蓝色,可用淀粉溶液检验溶液中是否存在碘单质,故A正确;
B.乙酸乙酯溶于乙醇,无法用分液漏斗分离乙酸乙酯与乙醇的混合物,故B错误;
C.NaOH与乙酸乙酯反应,不能用NaOH溶液除去乙酸乙酯中混有的乙酸,故C错误;
D.氨气极易溶于水,无法用排水集气法收集氨气,通常采用排空气法,故D错误;
故选A.
点评 本题考查了化学实验方案的评价,题目难度不大,涉及物质检验、分离与提纯、常见气体的收集方法等知识,明确常见物质分离与提纯方法为解答关键,注意掌握常见气体的检验方法,试题培养了学生的化学实验能力.

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目
4.下列离子能大量共存且溶液为无色透明的是( )
| A. | Na+、OH-、NO3-、HCO3- | B. | Na+、Fe3+、Cl-、SCN- | ||
| C. | Na+、Al3+、NO3-、Cl- | D. | K+、Cu2+、SO42-、OH- |
1.下列说法正确的是( )
| A. | 在化学反应过程中,发生物质变化的同时不一定发生能量变化 | |
| B. | 硝酸铵溶于水温度降低,这个过程吸热热量 | |
| C. | 同温同压下,H2和Cl2在光照和点燃条件下的△H不同 | |
| D. | 自发反应的熵一定增大,非自发反应的熵一定减小 |
8.下列对于苯的化学性质的叙述中正确的是( )
| A. | 苯与溴水发生加成反应而使溴水褪色 | |
| B. | 苯与溴水发生取代反应而使溴水褪色 | |
| C. | 苯不能使酸性高锰酸钾溶液褪色 | |
| D. | 苯与浓硝酸、浓硫酸的混合物发生的反应不是取代反应 |
14.下列说法不正确的是( )
| A. | 生物质能来深于植物及其加工产品所贮存的能量,直接燃烧是利用方式之一 | |
| B. | 石油的裂化与裂解都是化学变化,而煤的气化与液化是物理变化 | |
| C. | 用高压氢气、氧气制作燃料电池是氢能源利用的一种重要方式 | |
| D. | 化学反应过程中反应物的总能量小于生成物的总能量,往往伴随热量的吸收 |
 200.00mL溶液(黄绿色)$→_{通入适量SO_{2}△}^{(2)还原}$CuCl(白色沉淀)
200.00mL溶液(黄绿色)$→_{通入适量SO_{2}△}^{(2)还原}$CuCl(白色沉淀)