题目内容
下列实验或操作正确的是( )
A、 制氨气 |
B、 蒸发、浓缩、结晶 |
C、 配制稀硫酸 |
D、 用KMnO4溶液滴定 |
考点:化学实验方案的评价
专题:
分析:A.CaO和水反应生成氢氧化钙,反应放热,促进氨气的挥发;
B.蒸发应在蒸发皿中进行;
C.不能在量筒中稀释溶液;
D.高锰酸钾应放在酸性滴定管中.
B.蒸发应在蒸发皿中进行;
C.不能在量筒中稀释溶液;
D.高锰酸钾应放在酸性滴定管中.
解答:
解:A.CaO和水反应生成氢氧化钙,反应放热,促进氨气的挥发,可用于实验室制备少量氨气,氨气密度比空气小,可用向下排空法收集,故A正确;
B.坩埚用于加热固体,蒸发应在蒸发皿中进行,故B错误;
C.量筒只能在常温下使用,且只能用于量取一定体积的液体,不能在量筒中稀释溶液,故C错误;
D.高锰酸钾具有腐蚀性,应放在酸性滴定管中,故D错误.
故选A.
B.坩埚用于加热固体,蒸发应在蒸发皿中进行,故B错误;
C.量筒只能在常温下使用,且只能用于量取一定体积的液体,不能在量筒中稀释溶液,故C错误;
D.高锰酸钾具有腐蚀性,应放在酸性滴定管中,故D错误.
故选A.
点评:本题考查较为综合,涉及气体的制备、物质的分离、量筒的使用以及滴定操作,为高考常见题型,侧重于学生的分析能力和实验能力的考查,注意把握实验操作的注意事项,难度不大.

练习册系列答案
相关题目
在3Cu2S+22HNO3=6Cu(NO3)2+10NO↑+3H2SO4+8H2O的反应中,转移电子的总数为( )
| A、12 | B、22 | C、24 | D、30 |
下列溶液中,溶质的物质的量浓度为1mol/L的是( )
| A、含Na+为2mol的Na2SO4溶液 |
| B、将31g Na2O溶于水并配成1L的溶液 |
| C、将0.5mol/L的KNO3溶液100mL加热蒸发掉50g水的溶液 |
| D、将58.5gNaCl溶于1L水所得的溶液 |
设NA为阿伏加德罗常数的值.如果a g某气体中含有的分子数为b,则c g该气体在标准状况下的体积是( )
A、
| ||
B、
| ||
C、
| ||
D、
|
1.5mol空气在标准状况下占有的体积是( )
| A、22.4L |
| B、33.6L |
| C、44.8L |
| D、67.2L |
 用二氧化氯、铁酸钠(Na2FeO4)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术,ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.
用二氧化氯、铁酸钠(Na2FeO4)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术,ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.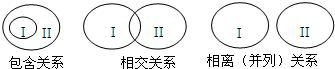 大多数概念间存在如图三种关系:
大多数概念间存在如图三种关系: