题目内容
 用二氧化氯、铁酸钠(Na2FeO4)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术,ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.
用二氧化氯、铁酸钠(Na2FeO4)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术,ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.(1)如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么,ClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率由大到小的顺序是
(2)Na2FeO4溶于水会放出一种无色无味气体,其杀菌消毒、吸附水中的悬浮杂质的原理可用离子方程式表示为
(3)工业以CH3OH与NaClO3为原料在酸性条件下制取ClO2,同时产生CO2气体,已知该反应分为两步进行,第一步为2ClO3-+2Cl-+4H+=2ClO2↑+Cl2↑+2H2O
①写出第二步反应的离子方程式
②工业生产时需在反应物中加少量Cl-,其作用是
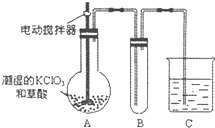
(4)已知二氧化氯是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.工业上用稍潮湿的KClO3和草酸在60℃时反应制得,ClO2也可以看做是亚氯酸(HClO2)和氯酸(HClO3)的混合酸酐.某学生用如图所示的装置模拟工业制取及收集ClO2,其中A为ClO2的发生装置,B为ClO2的凝集装置,C为尾气吸收装置.请问:
①A部分还应添加温度控制(如水浴加热)装置,B部分还应补充什么装置
②C中应装的试剂为
考点:性质实验方案的设计,氧化还原反应
专题:
分析:(1)以单位质量的氧化剂所得到的电子数来表示消毒效率,设质量均为m,消毒效率分别为
×5、
×3、
×2×1;
(2)高铁酸根离子具有强氧化性,所以能杀菌消毒,高铁酸根离子能发生氧化还原反应生成氧气,同时生成氢氧化铁,氢氧化铁具有吸附性;
(3))①由题中给出的反应物和生成物写出总的离子方程式再叠减第一步的离子方程式得出第二步的离子方程式;
②Cl-为反应的催化剂;
(4)①二氧化氯的沸点低,B为ClO2的凝集装置,B装置应降低温度;
②C为尾气吸收装置,可选择碱来吸收尾气,发生氧化还原反应.
| m |
| 67.5 |
| m |
| 166 |
| m |
| 71 |
(2)高铁酸根离子具有强氧化性,所以能杀菌消毒,高铁酸根离子能发生氧化还原反应生成氧气,同时生成氢氧化铁,氢氧化铁具有吸附性;
(3))①由题中给出的反应物和生成物写出总的离子方程式再叠减第一步的离子方程式得出第二步的离子方程式;
②Cl-为反应的催化剂;
(4)①二氧化氯的沸点低,B为ClO2的凝集装置,B装置应降低温度;
②C为尾气吸收装置,可选择碱来吸收尾气,发生氧化还原反应.
解答:
解:(1)以单位质量的氧化剂所得到的电子数来表示消毒效率,设质量均为m,ClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率分别为
×5、
×3、
×2×1,所以由大到小的顺序为ClO2>Cl2>Na2FeO4,故答案为:ClO2;Cl2;Na2FeO4;
(2)高铁酸根离子具有强氧化性,所以能杀菌消毒,高铁酸根离子和水反应生成氢氧化铁胶体,胶体具有吸附性是,所以能净水,反应方程式为:4FeO42-+10H2O=4Fe(OH)3+8OH-+3O2↑,
故答案为:4FeO42-+10H2O=4Fe(OH)3+8OH-+3O2↑;
(3)①由题中给出的反应物和生成物写出总的离子方程式再叠减第一步的离子方程式得出第二步的离子方程式为CH3OH+3Cl2+H2O=6Cl-+CO2+6H+,
故答案为:CH3OH+3Cl2+H2O=6Cl-+CO2+6H+;
②通过分析离子方程式得出,Cl-没有参加反应,作为催化剂,故答案为:催化剂;
(4)①二氧化氯的沸点低,B为ClO2的凝集装置,B装置应补充(冰水)冷凝装置,故答案为:(冰水)冷凝;
②C为尾气吸收装置,可选择NaOH溶液来吸收尾气,发生氧化还原反应为2ClO2+2NaOH═NaClO2+NaClO3+H2O,
故答案为:NaOH溶液;2ClO2+2NaOH═NaClO2+NaClO3+H2O.
| m |
| 67.5 |
| m |
| 166 |
| m |
| 71 |
(2)高铁酸根离子具有强氧化性,所以能杀菌消毒,高铁酸根离子和水反应生成氢氧化铁胶体,胶体具有吸附性是,所以能净水,反应方程式为:4FeO42-+10H2O=4Fe(OH)3+8OH-+3O2↑,
故答案为:4FeO42-+10H2O=4Fe(OH)3+8OH-+3O2↑;
(3)①由题中给出的反应物和生成物写出总的离子方程式再叠减第一步的离子方程式得出第二步的离子方程式为CH3OH+3Cl2+H2O=6Cl-+CO2+6H+,
故答案为:CH3OH+3Cl2+H2O=6Cl-+CO2+6H+;
②通过分析离子方程式得出,Cl-没有参加反应,作为催化剂,故答案为:催化剂;
(4)①二氧化氯的沸点低,B为ClO2的凝集装置,B装置应补充(冰水)冷凝装置,故答案为:(冰水)冷凝;
②C为尾气吸收装置,可选择NaOH溶液来吸收尾气,发生氧化还原反应为2ClO2+2NaOH═NaClO2+NaClO3+H2O,
故答案为:NaOH溶液;2ClO2+2NaOH═NaClO2+NaClO3+H2O.
点评:本题以氯及其化合物的性质考查氧化还原反应及物质的制备实验,把握习题中的信息及知识迁移应用为解答的关键,侧重学生综合应用能力及信息抽取和分析能力的考查,题目难度中等.

练习册系列答案
 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目
X.Y均为短周期元素,且X为ⅠA族元素,Y为ⅥA族元素.下列说法正确的是( )
| A、X的原子半径大于Y的原子半径 |
| B、由X.Y组成的离子化合物中阴离子核外有18个电子 |
| C、X2Y可能是离子化合物,也可能是共价化合物 |
| D、由X.Y组成的化合物,溶于水后溶液呈碱性 |
某溶液中存在大量的H+、SO42-、Cl-,该溶液中还可能大量存在的离子是( )
| A、OH- |
| B、Na+ |
| C、Ag+ |
| D、Ba2+ |
向装有乙醇的烧杯中投入一小块金属钠,下列对该实验现象的描述,不正确的是( )
| A、钠块沉在乙醇液面的下面 |
| B、反应较为和缓 |
| C、钠块在乙醇的液面上游动 |
| D、钠块表面有气体放出 |
下列实验或操作正确的是( )
A、 制氨气 |
B、 蒸发、浓缩、结晶 |
C、 配制稀硫酸 |
D、 用KMnO4溶液滴定 |
在实验中手不慎被玻璃划破,可用FeCl3溶液应急止血,其主要原因可能是( )
| A、FeCl3溶液有杀菌消毒作用 |
| B、FeCl3溶液能使血液聚集沉降 |
| C、FeCl3溶液能产生Fe(OH)3沉淀堵住伤口 |
| D、FeCl3能使血液发生化学反应 |
只用一种试剂可以区别Na2SO4、MgCl2、FeCl2、FeCl3、Al2(SO4)3、(NH4)2SO4六种溶液,这种试剂是( )
| A、Ba(OH)2 |
| B、NaOH |
| C、H2S |
| D、AgNO3 |