题目内容
20.1.2molO2与1.2molO3所含的分子数相等,与0.8molO3所含的氧原子数相等.分析 物质的量相等时含有的分子数相等;1.2mol氧气分子中含有2.4mol氧原子,臭氧分子中含有个氧原子,据此可计算出需要臭氧分子的物质的量.
解答 解:物质的量相等时含有的分子数相等,则1.2molO2与1.2molO3所含的分子数相等;
1.2molO2中含有O的物质的量为:1.2mol×2=2.4mol,还原O原子数相等时需要O3的物质的量为:n(O3)=$\frac{2.4mol}{3}$=0.8mol,
故答案为:1.2;0.8.
点评 本题考查了物质的量的简单计算,题目难度不大,明确物质的量与阿伏伽德罗常数的关系为解答关键,试题侧重基础知识的考查,培养了学生的化学计算能力.

练习册系列答案
相关题目
10.橙花醛是一种香料,结构简式为(CH3)2C=CHCH2CH2C(CH3)=CHCHO.下列说法正确的是( )
| A. | 橙花醛能够发生氧化反应,不能发生还原反应 | |
| B. | 橙花醛可以使溴水褪色 | |
| C. | 橙花醛是丙烯醛是同系物 | |
| D. | 橙花醛与分子式为C10H20O的酮互为同分异构体 |
8.现将质量分数为x%的H2SO4和3x%的H2SO4等体积混合,所得混合液的质量分数为m%,则m与x的关系为( )
| A. | m=2x | B. | m<2x | C. | m>2x | D. | 无法判断 |
15.下列说法正确的是( )
| A. | 常温常压下,22.4L氢气的物质的量为1mol | |
| B. | 标准状况下,11.2L水的物质的量为0.5mol | |
| C. | 标准状况下,32g硫的体积为22.4L | |
| D. | 常温常压下,22g二氧化碳的物质的量为0.5mol |
5.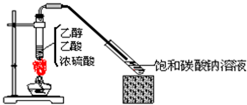 如图所示,实验室制乙酸乙酯1mL后,沿器壁加入紫色石蕊试液0.5mL,这时石蕊试液将存在于饱和碳酸钠溶液层与乙酸乙酯层之间(整个过程不振荡).对可能出现的现象,叙述正确的是
如图所示,实验室制乙酸乙酯1mL后,沿器壁加入紫色石蕊试液0.5mL,这时石蕊试液将存在于饱和碳酸钠溶液层与乙酸乙酯层之间(整个过程不振荡).对可能出现的现象,叙述正确的是
( )
 如图所示,实验室制乙酸乙酯1mL后,沿器壁加入紫色石蕊试液0.5mL,这时石蕊试液将存在于饱和碳酸钠溶液层与乙酸乙酯层之间(整个过程不振荡).对可能出现的现象,叙述正确的是
如图所示,实验室制乙酸乙酯1mL后,沿器壁加入紫色石蕊试液0.5mL,这时石蕊试液将存在于饱和碳酸钠溶液层与乙酸乙酯层之间(整个过程不振荡).对可能出现的现象,叙述正确的是( )
| A. | 石蕊层仍为紫色,有机层无色 | |
| B. | 石蕊层有两层,上层为紫色,下层为蓝色 | |
| C. | 石蕊层为三层环,由上而下是红、紫、蓝 | |
| D. | 石蕊层为三层环,由上而下是蓝、紫、红 |
12.在一定条件下,Na2CO3溶液存在水解平衡:CO32-+H2O?HCO3-+OH-,下列说法正确的是( )
| A. | 稀释溶液,水解平衡常数增大 | |
| B. | 加入NaOH固体,$\frac{c(HC{{O}_{3}}^{-})}{c(C{{O}_{3}}^{2-})}$减小 | |
| C. | 升高温度,平衡常数减小 | |
| D. | 通入CO2,pH增大 |
9.在制水泥、普通玻璃的工业生产中都需要的原料是( )
| A. | 粘土 | B. | 石灰石 | C. | 纯碱 | D. | 石英 |
10.下列说法正确的是( )
| A. | 胶体本质特征是具有丁达尔效应 | |
| B. | 摩尔是表示微粒多少的一个基本物理量 | |
| C. | 气体摩尔体积一定是22.4L | |
| D. | BaSO4虽然难溶于水,但BaSO4属于强电解质 |
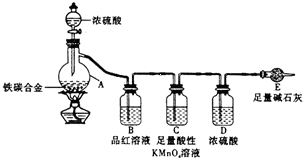 某学习小组设计了图示实验装置(省略了夹持仪器)来测定某铁碳合金中铁的质量分数.
某学习小组设计了图示实验装置(省略了夹持仪器)来测定某铁碳合金中铁的质量分数.