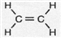
题目内容
9.在制水泥、普通玻璃的工业生产中都需要的原料是( )| A. | 粘土 | B. | 石灰石 | C. | 纯碱 | D. | 石英 |
分析 从碳酸钙的性质着手分析,石灰石的主要成分是碳酸钙,可以用于建筑材料和硅酸盐工业.
解答 解:石灰石的主要成分是碳酸钙,高温分解能生成氧化钙,可以用于建筑材料和硅酸盐工业,用于生成水泥和玻璃等,故选B.
点评 本题考查了碳酸钙的用途,完成此题,可以依据物质的性质进行.

练习册系列答案
相关题目
4.类推的思想方式在化学学习与研究中经常被采用,但类推出的结论是否正确最终要经过实验的验证.以下类推的结论中正确的是( )
| A. | SO2能使酸性KMnO4溶液褪色,故CO2也能使酸性KMnO4溶液褪色 | |
| B. | 盐酸与镁反应生成氢气,故硝酸与镁反应也生成氢气 | |
| C. | SO2能使品红溶液褪色,故CO2也能使品红溶液褪色 | |
| D. | 常温下浓硫酸能使铁和铝钝化,故常温下浓硝酸也能使铁和铝钝化 |
1.下列变化属于化学变化的是( )
①导电性;②瓦斯爆炸;③缓慢氧化;④丁达尔效应;⑤萃取;⑥焰色反应.
①导电性;②瓦斯爆炸;③缓慢氧化;④丁达尔效应;⑤萃取;⑥焰色反应.
| A. | ①②④ | B. | ②③ | C. | ②③⑥ | D. | ②③⑤ |