题目内容
6.如表各组物质中,满足组内甲、乙、丙任意两种物质在一定条件下均能发生反应的是( )| 物质组别 | 甲 | 乙 | 丙 |
| A | NH3 | O2 | HNO3 |
| B | Al | HCl | NaOH |
| C | SiO2 | NaOH | HCl |
| D | CO2 | Ca(OH)2 | NaHSO3 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.NH3与O2、HNO3反应,但O2、HNO3二者不反应;
B.Al与HCl、NaOH均反应,且HCl与NaOH反应;
C.SiO2与NaOH反应,二氧化硅与HCl不反应,NaOH与HCl反应;
D.CO2与Ca(OH)2反应,与NaHSO3 不反应,Ca(OH)2与NaHSO3反应.
解答 解:A.NH3与O2发生氧化还原反应生成NO和水,氨气与HNO3反应生成硝酸铵,但O2、HNO3二者不反应,则不满足组内任意两种物质在一定条件下均能发生反应,故A不选;
B.Al与HCl反应生成氯化铝和氢气,Al与NaOH溶液反应生成偏铝酸钠和氢气,且HCl与NaOH反应生成NaCl和水,组内任意两种物质在一定条件下均能发生反应,故B选;
C.SiO2与NaOH反应生成硅酸钠和水,SiO2与HCl不反应,且NaOH与HCl反应生成NaCl和水,组内任意两种物质在一定条件下不能都发生反应,故C不选;
D.CO2与Ca(OH)2反应生成亚硫酸钙和水,碳酸酸性小于亚硫酸,CO2与NaHSO3不反应,Ca(OH)2与NaHSO3反应生成亚硫酸钙,组内任意两种物质在一定条件下不都能发生反应,故D不选;
故选B.
点评 本题考查考查物质之间的反应,把握常见物质的性质及发生的化学反应为解答的关键,注意某些反应与量有关,明确性质与反应的关系即可解答,题目难度不大.

练习册系列答案
相关题目
1.下列说法正确的是( )
| A. | 陶瓷、水泥、石英玻璃、光导纤维均属于硅酸盐产品 | |
| B. | 煤干馏得到的煤焦油,其主要用途是经蒸馏得到燃油,这一应用可体现“低碳生活”的理念 | |
| C. | 埃博拉病毒对化学药品敏感,乙醇、酚类、次氯酸钠溶液、双氧水均可以将病毒氧化而达到消毒的目的 | |
| D. | 扫描隧道显微技术、超分辨荧光显微技术等科技手段的发展,促进了人类对微观结构的探索,可实现对原子或分子的操控,使科学研究迈入更高水平 |
11.下列化学用语中,说法正确的是( )
| A. | CO2分子的结构式O-C-O | B. | 乙醇的分子式C2H6O | ||
| C. | Mg2+结构示意图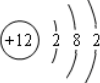 | D. | NaCl的电子式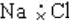 |
18.水溶液中能大量共存的一组离子是( )
| A. | Na+、Al3+、Cl-、CO32- | B. | Na+、Fe3+、Cl-、NO3- | ||
| C. | H+、Na+、ClO-、S2- | D. | K+、NH4+、OH-、SO42- |
15.已知X、Y、Z、W均为元素周期表中的短周期元素,具有如下特征:
(1)W的元素符号是S,其原子结构示意图为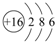 .
.
(2)四种元素中,原子半径最大的是Na(填元素符号).
(3)X2Y的电子式是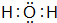 .
.
(4)Z2Y2中含有化学键的类型是离子键、共价键.
(5)Y的非金属性强(填“强”或“弱”)于W.请用原子结构的知识解释其原因:O原子比S原子少一个电子层数,O原子半径较大,得电子能力较强.
(6)将WY2通入BaCl2溶液中,没有明显变化,再向其中加入Z元素最高价氧化物对应的水化物,可观察到的现象是有白色沉淀生成,发生反应的离子方程式是SO2+2OH-+Ba2+=BaSO3↓+H2O.
| 元素 | 特征 |
| X | 周期表中,原子半径最小 |
| Y | 常温下,可以形成Y2、Y3型的气体单质 |
| Z | 其原子内层电子与最外层电子数之比为10:1 |
| W | 最高化合价为+6 |
 .
.(2)四种元素中,原子半径最大的是Na(填元素符号).
(3)X2Y的电子式是
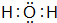 .
.(4)Z2Y2中含有化学键的类型是离子键、共价键.
(5)Y的非金属性强(填“强”或“弱”)于W.请用原子结构的知识解释其原因:O原子比S原子少一个电子层数,O原子半径较大,得电子能力较强.
(6)将WY2通入BaCl2溶液中,没有明显变化,再向其中加入Z元素最高价氧化物对应的水化物,可观察到的现象是有白色沉淀生成,发生反应的离子方程式是SO2+2OH-+Ba2+=BaSO3↓+H2O.
 X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大.X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态.请回答下列问题:
X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大.X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态.请回答下列问题: