题目内容
7.2010年春至2013年连续四年发生在云南省的严重旱情牵动了全国人民的心,引起人们对水资源的再次重视.水是组成生命体的重要化学物质,有关水的反应有很多.(1)在pH=1的水溶液中,一定大量共存的是①③(填序号)
①NH4+、Al3+、Br-、SO42- ②Na+、Fe2+、Cl-、NO3-
③K+、Ba2+、Cl-、NO3- ④K+、Na+、HCO3-、SO42-
(2)在下列反应中,水仅做氧化剂的是CD(填字母,下同),水既不做氧化剂又不做还原剂的是B.
A.2F2+2H2O=4HF+O2
B.2Na2O2+2H2O=4NaOH+O2↑
C.CaH2+2H2O=Ca(OH)2+2H2↑
D.3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2
(3)“神舟七号”飞船上的能量主要来自于太阳能和燃料电池,H2、O2和KOH的水溶液可形成氢氧燃料电池,反应产生的水经冷凝后可作为航天员的饮用水,当得到1.8L饮用水时,电池内转移的电子数为200NA.(NA表示阿伏加德罗常数的数值)
分析 (1)pH=1的溶液呈强酸性,生成气体、沉淀、弱电解质、络合物或发生双水解反应、氧化还原反应的离子之间不能大量共存;
(2)属于氧化还原反应,说明该反应中有电子转移,水制作氧化剂,说明该反应中水中元素得电子化合价降低,水既不是氧化剂又不是还原剂,说明水中各元素化合价不变;
(3)该燃料电池中,负极上氢气失电子和氢氧根离子反应生成水,根据水和转移电子之间的关系式计算转移电子数.
解答 解:(1)pH=1的溶液呈强酸性,溶液中存在大量氢离子,
①NH4+、Al3+、Br-、SO42- 之间不反应,且和氢离子也不反应,所以能大量共存,故①正确;
②强酸性条件下,Fe2+和NO3-能发生氧化还原反应而不能大量共存,故②错误;
③K+、Ba2+、Cl-、NO3-之间不反应且和氢离子也不反应,所以能大量共存,故③正确;
④HCO3-和氢离子反应生成二氧化碳和水,所以不能大量共存,故④错误;
故答案为:①③;
(2)A.2F2+2H2O═4HF+O2 中F元素化合价由0价变为-1价、O元素化合价由-2价变为0价,所以水是还原剂;
B.2Na2O2+2H2O═4NaOH+O2↑中过氧化钠中O元素化合价由-1价变为-2价和0价,水中各元素化合价不变,所以水既不是氧化剂又不是还原剂;
C.CaH2+2H2O═Ca(OH)2+2H2↑ 中H元素化合价由-1价、+1价变为0价,所以水是氧化剂、氢化钙是还原剂;
D.3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2中Fe元素化合价由0价变为+2价和+3价、H元素化合价由+1价变为0价,所以水是氧化剂、Fe是还原剂,
则水只作氧化剂的是CD、水既不作氧化剂又不作还原剂的是B,
故答案为:CD;B;
(3)该燃料电池中,负极上氢气失电子和氢氧根离子反应生成水,电极反应式为H2-2e-+2OH-=2H2O,电池反应式为2H2+O2=2H2O,1.8L水的质量为1800g,1.8L水的物质的量=$\frac{1800g}{18g/mol}$=100mol,水和转移电子之间的关系式为H2O~2e-,生成100mol水转移电子电子数=100mol×2×NA/mol=200NA,
故答案为:200NA.
点评 本题考查较综合,涉及氧化还原反应、原电池原理、离子共存等知识点,题目难度中等,注意利用基本原理、基本概念分析解答,试题培养了学生的分析能力及灵活应用能力.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 常温常压下,8g甲烷中含C-H键的数目为4NA | |
| B. | 25℃时,1L pH=13的Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| C. | 1 mol冰醋酸和1mol乙醇经催化加热反应生成H2O的分子数为NA | |
| D. | 标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.1NA |
| A. | 对于相同浓度的弱酸HX和HY(前者的Ka较小)溶液,加水稀释相同倍数时,HY溶液的pH改变值大于HX溶液的pH改变值 | |
| B. | 在NH3•H2O和NH4Cl浓度均为0.1 mol•L-1的体系中,外加少量酸或碱时,溶液的pH可保持基本不变 | |
| C. | 在NaH2PO4水溶液中存在关系:c(H3PO4)+c(H+)=c(HPO42-)+c(PO43-)+c(OH-) | |
| D. | 沉淀溶解平衡AgI?Ag++I- 的平衡常数为8.5×10-17,不能说明难溶盐AgI是弱电解质 |
| A. | 从海水中提取镁 | B. | 用酒精测试仪检测酒驾 | ||
| C. | 将氯气通入冷的消石灰中制漂白粉 | D. | 石油分馏 |
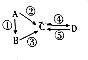
(1)若A是淡黄色固体,C是造成酸雨的物质,则符合条件的B的化学式是H2S(只写一种).1molA转化为C时,转移电子4mol.
(2)若B、D两种物质均具有两性,向反应④中通入过量的温室气体,可将C转化为D,则C与过量盐酸反应的离子方程式为AlO2-+4H+=Al3++2H2O.
(3)若A是太阳能电池用的光伏材料,B、C、D所含元素均为2种,反应①、②中的反应物除A外均含有空气中的单质,则物质D的化学式是SiF4,写出D的一种用途:有机硅化合物的合成材料.
(4)若含同种元素的物质A、B、C、D均可用于杀菌消毒、漂白,其中A是黄绿色气体,C的水溶液呈酸性,D的水溶液呈碱性.元素种类与物质之间的关系如表:
| 物质 | A | B | C | D |
| 元素种类 | 1 | 2 | 3 | 3 |
 ,物质C的化学式是HClO,写出反应A→D的离子方程式:Cl2+2OH-=Cl-+ClO-+H2O.
,物质C的化学式是HClO,写出反应A→D的离子方程式:Cl2+2OH-=Cl-+ClO-+H2O. | A. | 用排饱和NaHCO3溶液的方法收集CO2 | |
| B. | 在H2O2溶液中加入MnO2加快生成O2的速率 | |
| C. | 工业制氨气时,使氨液化从混合气体中分离出来 | |
| D. | 加压条件下有利于SO2和O2反应生成SO3 |
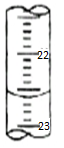 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下: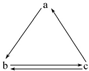 下列所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
下列所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )