题目内容
16.根据下表中烃的分子式排列规律,判断空格中烃的分子式是( )| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| CH4 | C2H4 | C3H4 | C4H10 | C5H10 | C6H10 | C7H16 |
| A. | C7H18 | B. | C7H14 | C. | C8H18 | D. | C8H16 |
分析 根据表格中物质的化学式,找出从1-8各物质的分子组成或构成上的规律,判断符合该规律的化学式.
解答 解:从1到8,物质的分子中C原子个数递增,各物质的分子构成中H原子符合1、2、3中氢原子数相同,4、5、6中氢原子个数相等,则可推断7、8、9的H原子个数相等,即物质8的分子中含有16个H原子;
综合以上分析,物质8的化学式为C8H16;
故选D.
点评 本题考查了化学式规律总结,对比化学式,发现物质组成与构成中所存在的规律,表现出归纳与整理的能力,题目难度不大.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
17.验证周期表中元素性质的变化规律:
(1)同一周期内从左到右元素的金属性逐渐减弱;
(2)同一主族内从上到下元素的非金属性逐渐减弱.
从下表(Ⅰ)中选择实验方法,从(Ⅱ)中选择相应的实验现象,上下对应地填写在答案的空格中.(不一定全选)
答案:
(1)同一周期内从左到右元素的金属性逐渐减弱;
(2)同一主族内从上到下元素的非金属性逐渐减弱.
从下表(Ⅰ)中选择实验方法,从(Ⅱ)中选择相应的实验现象,上下对应地填写在答案的空格中.(不一定全选)
| 实验方法(Ⅰ) | 实验现象(Ⅱ) |
| A.钠与冷水反应 | a.溶液变红色 |
| B.向NaOH溶液中滴加酚酞 | b.产生白烟 |
| C.点燃H2S | c.反应不十分剧烈,产生的气体能燃烧 |
| D.蘸浓氨水与浓盐酸的两玻璃棒接近 | d.浮于水面,熔成小球,迅速向四处游动 |
| E.NaI溶液中加入溴水 | e.生成白色胶状沉淀,后又溶解 |
| F.镁带与沸水反应 | f.产生大量气泡、气体可以点燃 |
| G.AlCl3溶液中加入NaOH溶液 | g.溶液变棕黄色 |
| H.NaCl溶液中加入溴水 | h.发出耀眼的强光,生成白色物质 |
| I.镁带空气中燃烧 | i.发出淡蓝色火焰 |
| J.NaBr溶液中加入氯水 | j.观察不出什么现象 |
| K.铝片与2mnol/L盐酸反应 | k.溶液变橙色 |
| (1)同周期 | (2)同主族 | |
| Ⅰ | ||
| Ⅱ |
4.配制FeCl3溶液时,为防止出现浑浊,可向该溶液中加入少量( )
| A. | 铁 | B. | 盐酸 | C. | 氯化钠 | D. | 氢氧化钠 |
11.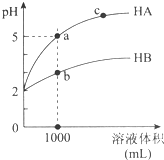 室温下,pH均为2的两种一元酸HA和HB各1mL,分别加水稀释,pH随溶液体积的变化曲线如图所示.下列说法正确的是( )
室温下,pH均为2的两种一元酸HA和HB各1mL,分别加水稀释,pH随溶液体积的变化曲线如图所示.下列说法正确的是( )
 室温下,pH均为2的两种一元酸HA和HB各1mL,分别加水稀释,pH随溶液体积的变化曲线如图所示.下列说法正确的是( )
室温下,pH均为2的两种一元酸HA和HB各1mL,分别加水稀释,pH随溶液体积的变化曲线如图所示.下列说法正确的是( )| A. | HA的酸性比HB的酸性弱 | |
| B. | a点溶液的导电性比c点溶液的导电性弱 | |
| C. | 若两溶液无限稀释,则它们的c(H+)相等 | |
| D. | 对a、b两点溶液同时升高温度,则$\frac{c({A}^{-})}{{c(B}^{-})}$增大 |
1.Na和Na+两种粒子中,不相同的是( )
①核内质子数;②核外电子数;③最外层电子数;④核外电子层数.
①核内质子数;②核外电子数;③最外层电子数;④核外电子层数.
| A. | ①② | B. | ②③ | C. | ②③④ | D. | ①③ |
8.下列原子的外围电子排布式正确的是( )
| A. | S:3p4 | B. | Cr:3d44s2 | C. | Se:5s25p6 | D. | Cu:3d104s1 |
5.下列说法不正确的是( )
| A. | 氢能、核能均是无污染的高效能源 | |
| B. | 公共汽车大部分采用天然气作为燃料可减少对大气的污染 | |
| C. | 把煤转化为液态燃料可提高煤的燃烧效率 | |
| D. | 使用催化剂,能增大活化分子百分数,所以反应速率增大 |
6.下列离子方程式正确的是( )
| A. | FeCl3溶液中加入过量的氨水:Fe3++3OH-→Fe(OH)3↓ | |
| B. | AlCl3溶液中加入过量的氨水:Al3++4OH-→AlO2-+2H2O | |
| C. | 金属铁与过量的稀盐酸反应:2Fe+6H+→2Fe3++3H2↑ | |
| D. | 氧化铝与氢氧化钠溶液反应:Al2O3+2OH-→2AlO2-+H2O |