题目内容
13.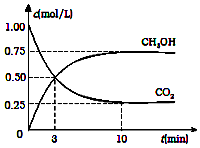 降低大气中CO2的含量及有效地开发利用CO2,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为2L的恒容密闭容器中,充入2mol CO2和6mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示:
降低大气中CO2的含量及有效地开发利用CO2,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为2L的恒容密闭容器中,充入2mol CO2和6mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示:(1)从反应开始到平衡,用CO2表示该反应的平均速率ν(CO2)=0.075mol/(L•min);
(2)平衡时氢气的物质的量浓度为0.75;
(3)该条件下该反应的平衡常数K=$\frac{16}{3}$;
(4)下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是CD;
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出去 D.再充入1mol CO2和3mol H2
(5)当达到平衡时,不再维持恒容,充入氩气保持压强不变,平衡将逆向(填“正向”、“逆向”或“不移动”).
分析 (1)根据v=$\frac{△c}{△t}$计算;
(2)三行计算得到氢气的平衡浓度;
(3)根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积计算;
(4)要使$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$增大,应使平衡向正反应方向移动;
(5)当达到平衡时,不再维持恒容,充入氩气保持压强不变,体积增大,平衡向气体体积增大的方向进行;
解答 解:(1)①利用三段式解题法计算
CO2(g)+3H2(g)?CH3OH(g)+H2O(g),
开始(mol/L):1 3 0 0
变化(mol/L):0.75 2.25 0.75 0.75
平衡(mol/L):0.25 0.75 0.75 0.75
v(CO2)=$\frac{0.75mol/L}{10min}$=0.075mol/(L•min)
故答案为:0.075;
(2)上述计算可知氢气平衡浓度为0.75mol/L,
故答案为:0.75;
(3)平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,则k=$\frac{c(C{H}_{3}OH)c({H}_{2}O)}{c(C{O}_{2}){c}^{3}({H}_{2})}$=$\frac{0.75×0.75}{0.25×0.7{5}^{3}}$=$\frac{16}{3}$,
故答案为:$\frac{16}{3}$;
(4)要使$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$增大,应使平衡向正反应方向移动,
A.因正反应放热,升高温度平衡向逆反应方向移动,则$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$减小,故A错误;
B.充入He(g),使体系压强增大,但对反应物质来说,浓度没有变化,平衡不移动,$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$不变,故B错误;
C.将H2O(g)从体系中分离,平衡向正反应方法移动,$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$增大,故C正确;
D.再充入1mol CO2和3mol H2,等效于在原来基础上缩小体积一半,压强增大,平衡向正反应方向移动,则$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$增大,故D正确.
故答案为:CD;
(5)当达到平衡时,不再维持恒容,充入氩气保持压强不变,体积增大,平衡向气体体积增大的方向进行,CO2(g)+3H2(g)?CH3OH(g)+H2O(g),平衡逆向进行,
故答案为:逆向;
点评 本题考查较为综合,涉及化学平衡计算以及平衡移动等问题,题目难度中等,注意根据图象计算各物质的平衡浓度为解答该题的关键.

 阅读快车系列答案
阅读快车系列答案| A. | 标准状况下,22.4L乙醇完全燃烧后生成CO2的分子数为2NA | |
| B. | 56g的铁发生氧化还原反应,一定失去3NA个电子 | |
| C. | 标准状况下,22.4L氧气和二氧化碳混合气体中所含氧原子数为2NA | |
| D. | 0.1mol/L稀硫酸中含有SO42-离子数为0.1NA |
| A. | 乙醇-燃料 | B. | 蛋白质-生产葡萄糖 | ||
| C. | 淀粉-酿酒 | D. | 油脂-制造肥皂 |
| A. | 乙醛 | B. | 乙酸 | C. | 甲烷 | D. | 丙酮 |
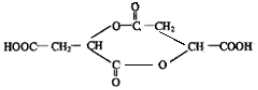 .
.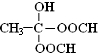 .(已知:
.(已知: )
)
 4NO(g)+6H2O(g) △H=-1 025kJ/mol,该反应是一个可逆反应。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是( )
4NO(g)+6H2O(g) △H=-1 025kJ/mol,该反应是一个可逆反应。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是( )
 2NH3的反应中,经过一段时间后,NH3的浓度增加了0.6mol/L,在此时间内,用H2表示的反应速率为0.45mol/(L·s),反应所经过的时间是( )
2NH3的反应中,经过一段时间后,NH3的浓度增加了0.6mol/L,在此时间内,用H2表示的反应速率为0.45mol/(L·s),反应所经过的时间是( )